Video-charla del Dr. García de Sola sobre la hemorragia cerebral y los aneurismas

Hemorragia cerebral por aneurismas: concepto, diagnóstico y tratamiento

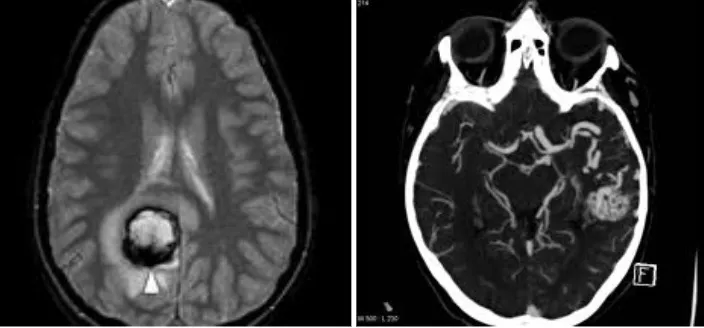
La hemorragia cerebral constituye una de las formas más graves de accidente cerebrovascular o ictus, representando entre el 20 y el 30% de todos los casos. Dentro de este grupo, la hemorragia subaracnoidea causada por la rotura de un aneurisma cerebral es una entidad especialmente relevante por su elevada morbimortalidad y la necesidad de un tratamiento urgente.
Los aneurismas cerebrales son dilataciones en forma de saco que se producen en las paredes arteriales, generalmente en las bifurcaciones de los grandes vasos que conforman el polígono de Willis. Se estima que hasta un 1% de la población puede albergar un aneurisma cerebral, aunque solo una proporción limitada llegará a romperse.
Cuando se produce la rotura, el cuadro clínico se manifiesta con una cefalea brusca e intensa, náuseas, vómitos, rigidez de nuca y, en ocasiones, déficit neurológico. La mortalidad asociada a la primera hemorragia alcanza el 20%, cifra que se eleva drásticamente con cada episodio de resangrado. Por ello, el cierre precoz del aneurisma —ya sea mediante cirugía o embolización— resulta fundamental.
El diagnóstico se apoya en la tomografía computarizada (TAC) y la arteriografía cerebral.
El abordaje terapéutico requiere un equipo multidisciplinario que integre neurología, neurocirugía, radiología intervencionista y neurorradiología, enmarcado en el protocolo del código ictus, donde el factor tiempo resulta determinante para mejorar el pronóstico del paciente.
Rafael García de Sola
Director de la Cátedra UAM «Innovación en Neurocirugía»
Jefe del Servicio de Neurocirugía
Hospital Ntra. Sra. del Rosario
Madrid
Concepto de accidente cerebrovascular
El accidente cerebrovascular (ACV), conocido actualmente como ictus —término que procede del griego y significa «golpe»—, se produce cuando de forma brusca se interrumpe la irrigación sanguínea en un territorio cerebral determinado. Esta interrupción provoca una aparición súbita de síntomas que pueden incluir cefalea de intensidad variable y déficit neurológico, como pérdida de fuerza en una extremidad, alteraciones del habla o disminución de la visión.
Existen dos grandes mecanismos por los que puede detenerse la circulación cerebral, dando lugar a dos tipos fundamentales de ictus con características, causas y tratamientos diferentes.
Tipos de ictus
Ictus isquémico
El ictus isquémico se produce por la oclusión de un vaso sanguíneo cerebral. La arteria queda bloqueada y el territorio que irriga se queda sin aporte de oxígeno. Esta oclusión puede originarse por dos mecanismos principales:
- Obstrucción progresiva (aproximadamente el 70% de los casos): la acumulación gradual de colesterol y otras sustancias forma una placa de ateroma que va estrechando la arteria hasta cerrarla por completo.
- Embolia (alrededor del 10%): un coágulo se desprende, generalmente desde el corazón, y viaja por la circulación sanguínea hasta que se detiene en un vaso cerebral de menor calibre, obstruyéndolo.
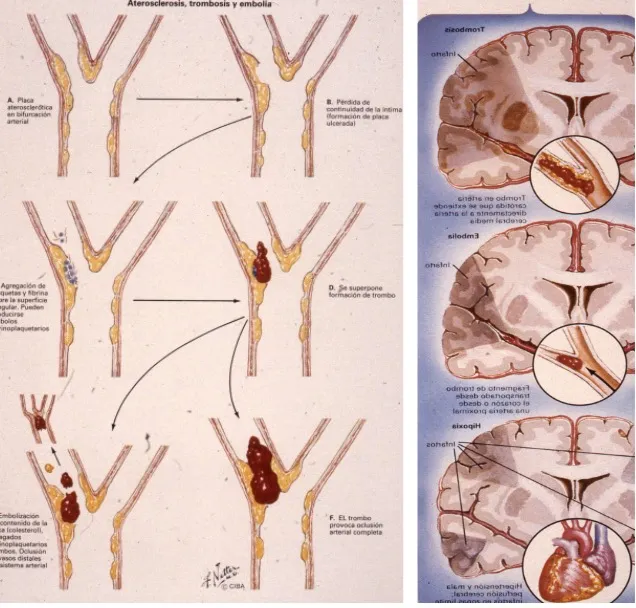
Ictus hemorrágico
El ictus hemorrágico representa el mecanismo opuesto: en lugar de una oclusión, se produce una rotura de la pared arterial, lo que genera un sangrado dentro del cráneo. Constituye entre el 20 y el 30% de todos los ictus y presenta una gran diversidad de patología. Según la localización del sangrado, se distinguen dos tipos principales:
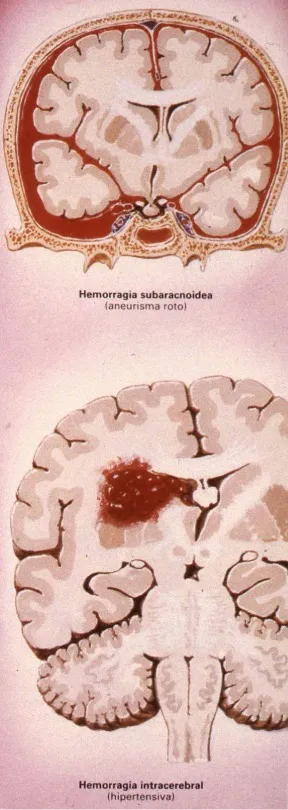
- Hemorragia subaracnoidea: la sangre se vierte en el espacio subaracnoideo, donde circula el líquido cefalorraquídeo (LCR) alrededor del cerebro.
- Hemorragia intraparenquimatosa: el sangrado se produce dentro del propio tejido cerebral (parénquima).
Incidencia del ictus
Según la Organización Mundial de la Salud (OMS), la incidencia del ictus se sitúa en torno a los 200 casos nuevos por cada 100.000 habitantes. En España, aunque la cifra global no se conoce con total precisión, se estima entre 120 y 350 casos por cada 100.000 habitantes al año.
La edad constituye un factor determinante: las tasas de ictus se multiplican por 10 en la población mayor de 75 años, y entre un 5 y un 11% de las personas mayores de 65 años refieren antecedentes clínicos de ictus.
Tipos de hemorragia cerebral
La hemorragia cerebral, como forma de ictus, puede clasificarse en dos grandes tipos según el lugar donde se acumula la sangre. Cada uno de ellos presenta características clínicas y pronósticas diferentes:
- Hemorragia subaracnoidea (10% de los ictus): la sangre pasa al espacio subaracnoideo donde circula el líquido cefalorraquídeo. Se manifiesta con cefalea intensa y un déficit neurológico generalmente mínimo en las fases iniciales.
- Hemorragia intraparenquimatosa (10% de los ictus): el sangrado se produce dentro del tejido cerebral, cursando con cefalea y síntomas focales de déficit neurológico según la zona del cerebro afectada.
Hemorragia subaracnoidea
La hemorragia subaracnoidea (HSA) se produce cuando la sangre se vierte al espacio subaracnoideo, donde circula el líquido cefalorraquídeo alrededor del cerebro. Se trata de una enfermedad frecuente y potencialmente curable, pero cuya morbimortalidad, considerada globalmente, es elevada.
Etiología de la hemorragia subaracnoidea
Ante una hemorragia subaracnoidea, más del 50% de los casos se deben a aneurismas cerebrales, lo que convierte a esta patología en la causa más frecuente. Por ello, cuando se diagnostica una HSA, lo primero que debe sospecharse —mientras no se demuestre lo contrario— es la presencia de un aneurisma. Las principales causas son:
- Aneurismas cerebrales: 60-70% de los casos
- Malformaciones vasculares: 5%
- Hipertensión arterial: 5-10%
- Discrasias sanguíneas (alteraciones de la coagulación): 10-15%
- Tumores: excepcional
- Causa idiopática (desconocida): 10-20%
Morbimortalidad de la HSA aneurismática
Los datos epidemiológicos reflejan la gravedad de esta patología. Hasta el 12% de los pacientes que sufren una HSA no son adecuadamente diagnosticados o fallecen antes de llegar al hospital. De los que llegan vivos, alrededor del 10-30% fallecen en los primeros días de ingreso.
Entre los supervivientes, el 50% presenta una morbilidad significativa, con una tasa de discapacidad del 35-60%. La mortalidad global oscila entre el 32 y el 67%, mientras que la mortalidad hospitalaria en España se sitúa en torno al 26%, cifra similar a la descrita en estudios internacionales. Además, hasta el 54% de los pacientes no alcanzan una recuperación funcional completa, y los pacientes mayores de 70 años presentan un peor pronóstico funcional para cada grado neurológico de la HSA.
Aneurisma cerebral
Concepto
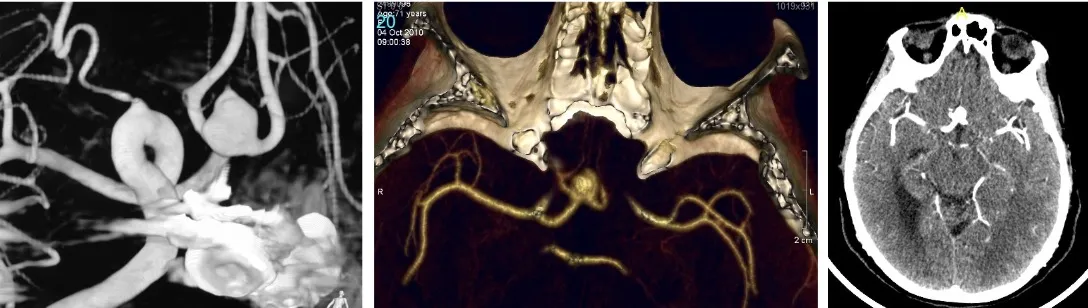
Un aneurisma cerebral es una dilatación de la luz arterial, es decir, un ensanchamiento anormal en la pared de una arteria del cerebro. En el ámbito cerebral, los aneurismas adoptan fundamentalmente dos formas:
- Saculares: son los más frecuentes (más del 90% de los aneurismas cerebrales). Se desarrollan en forma de saco que va creciendo progresivamente a partir de un punto débil de la pared arterial.
- Fusiformes: mucho más raros en el cerebro, aunque son más habituales en otras localizaciones como la arteria aorta. Consisten en una dilatación alargada de todo el segmento arterial.
Etiología de los aneurismas
Los aneurismas cerebrales pueden clasificarse según su origen en varios tipos:
- Congénitos: se producen por una deficiencia en la capa elástica de la pared arterial, presente desde el nacimiento. Es la causa más frecuente.
- Adquiridos: se desarrollan a lo largo de la vida debido a factores como la hipertensión arterial (HTA), el colesterol elevado y otros factores de riesgo cardiovascular que deterioran progresivamente la pared del vaso.
- Micóticos: son raros y se producen por infecciones que debilitan la pared arterial.
- Traumáticos: de carácter excepcional, originados por un traumatismo que daña la arteria.
Etiopatogenia
El punto mecánicamente más débil de una arteria es su bifurcación, el lugar donde el vaso se divide en dos ramas. En esta zona, el flujo sanguíneo impacta constantemente contra la pared antes de dividirse, sometiendo ese punto a un estrés mecánico continuo a lo largo de toda la vida.
Una vez que la pared arterial comienza a deformarse, entra en juego la ley de Laplace: la tensión que soportan las paredes de un vaso es proporcional a su radio. A medida que el aneurisma crece, la pared se hace cada vez más fina y débil, mientras que la tensión que soporta aumenta progresivamente, de modo similar a un globo que se va inflando hasta que termina por romperse. Este proceso convierte el crecimiento del aneurisma en un fenómeno progresivo que, con frecuencia, culmina en la rotura.
Se estima que hasta un 1% de la población podría tener aneurismas cerebrales, aunque afortunadamente solo aproximadamente 1 de cada 5 llegará a romperse.
Evolución natural del aneurisma
El aneurisma cerebral puede seguir tres patrones evolutivos principales:
- Rotura: es la evolución natural más frecuente. El aneurisma crece hasta que se rompe en algún punto de su pared debilitada, provocando una hemorragia subaracnoidea.
- Crecimiento con trombosis y embolias: cuando el aneurisma crece sin romperse, la circulación sanguínea en su interior se enlentece, se forman trombos que pueden desprenderse y generar embolias cerebrales.
- Aneurisma gigante como masa expansiva: en casos excepcionales, el aneurisma alcanza un tamaño tan grande que se comporta como un tumor, comprimiendo las estructuras cerebrales vecinas y produciendo daño por efecto de masa.
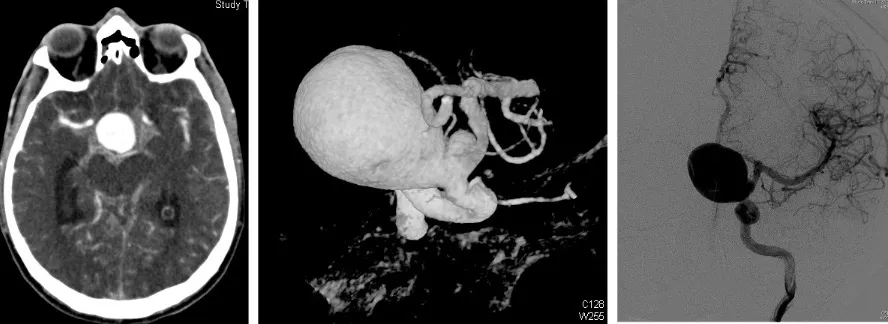
Historia natural de la rotura aneurismática
Cuando un aneurisma se rompe, se desencadena una secuencia de eventos que es fundamental comprender para entender la gravedad y urgencia del tratamiento:
En primer lugar, la rotura provoca una entrada brusca de sangre en el espacio subaracnoideo, con un aumento súbito de la presión intracraneal. Afortunadamente, el propio organismo genera un mecanismo de defensa: se forma un coágulo en el punto de rotura que cierra temporalmente la brecha. Sin embargo, el líquido cefalorraquídeo está diseñado para evitar la coagulación, por lo que sus componentes van erosionando ese coágulo (lisis), lo que abre la posibilidad de un nuevo sangrado o resangrado.
Además, como mecanismo de protección natural, se produce un vasoespasmo: la arteria que alberga el aneurisma se contrae para reducir la presión sanguínea en la zona. Por otro lado, la presencia de sangre en el líquido cefalorraquídeo puede obstruir su circulación normal y provocar una hidrocefalia (acumulación excesiva de líquido en las cavidades cerebrales).
Localización de los aneurismas
Los aneurismas cerebrales se localizan preferentemente en los grandes vasos del cerebro, concretamente en las bifurcaciones arteriales. La estructura anatómica donde se concentran con mayor frecuencia es el polígono de Willis, un anillo arterial situado en la base del cerebro formado por la confluencia de las arterias principales.
En cuanto a su distribución, el 90% de los aneurismas se sitúan en la circulación anterior, que comprende las arterias carótida, cerebral anterior y cerebral media. El 10% restante se localizan en la circulación posterior (sistema vértebro-basilar), que, aunque menos frecuente, resulta más compleja de tratar desde el punto de vista médico-quirúrgico.
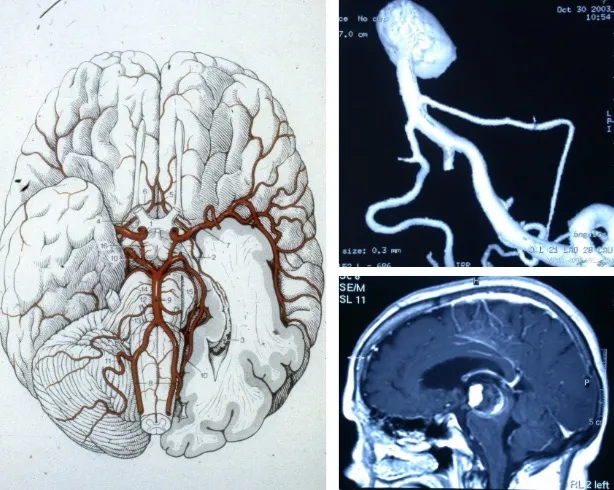
Manifestaciones clínicas
La forma de presentación clínica del aneurisma cerebral depende fundamentalmente de su mecanismo de actuación. La más frecuente y grave es la rotura, que provoca un cuadro absolutamente brusco caracterizado por:
- Cefalea brusca e intensa: es el síntoma cardinal. Los pacientes la describen como un dolor de cabeza diferente a cualquier otro que hayan experimentado, de aparición súbita y gran intensidad.
- Náuseas y vómitos.
- Fotofobia (intolerancia a la luz), como consecuencia de la irritación meníngea.
- Rigidez de nuca: signo de meningismo por la presencia de sangre en el espacio subaracnoideo.
- Déficit neurológico: variable según la localización y gravedad del sangrado.
Las otras formas de manifestación —por crecimiento progresivo del aneurisma o por embolia— cursan de manera diferente y son menos frecuentes que la rotura.
Escalas clínicas: clasificación de Hunt y Hess
Para valorar la situación clínica del paciente tras una hemorragia subaracnoidea, los especialistas utilizan la escala de Hunt y Hess (1968), que establece cinco grados de gravedad. Esta clasificación resulta fundamental porque se correlaciona directamente con las posibilidades de supervivencia del paciente:
| Grado | Estado clínico | Supervivencia |
|---|---|---|
| I | Asintomático | 95% |
| II | Cefalea. Meningismo | 80% |
| III | Confusión. Somnolencia. Déficit leve | 70% |
| IV | Estupor-Coma. Déficit acentuado | 50% |
| V | Coma profundo | 5% |
Como puede observarse, las posibilidades de supervivencia disminuyen drásticamente a medida que empeora el estado neurológico del paciente, pasando del 95% en pacientes asintomáticos a tan solo un 5% en aquellos que se encuentran en coma profundo.
Pronóstico
Mortalidad según el número de hemorragias
La mortalidad asociada al aneurisma cerebral aumenta de forma alarmante con cada nuevo episodio de sangrado:
| Episodio hemorrágico | Mortalidad |
|---|---|
| Primera hemorragia | 20% |
| Resangrado (segunda hemorragia) | 40-50% |
| Tercera hemorragia | 90-100% |
Riesgo de resangrado
El riesgo de que un aneurisma vuelva a sangrar tras la primera rotura es un factor crítico en la toma de decisiones terapéuticas. Si no se interviene, este riesgo aumenta progresivamente con el paso del tiempo:
| Período | Riesgo de resangrado |
|---|---|
| Primeros días | 4% |
| Primeros 15 días | 20% |
| 2 meses | 50% |
| 5 años | 75% |
Estos datos ponen de manifiesto la necesidad imperativa de realizar un cierre precoz del aneurisma para evitar el resangrado y la mortalidad asociada.
Diagnóstico
El diagnóstico de la hemorragia subaracnoidea y del aneurisma causante se realiza en dos fases complementarias:
En primer lugar, se confirma la presencia de sangre en el líquido cefalorraquídeo. La prueba fundamental es la tomografía computarizada (TAC), que permite visualizar la sangre en el espacio subaracnoideo. Cuando existen dudas diagnósticas —por ejemplo, para diferenciarlo de una meningitis—, puede realizarse una punción lumbar que confirme la presencia de sangre en el LCR.
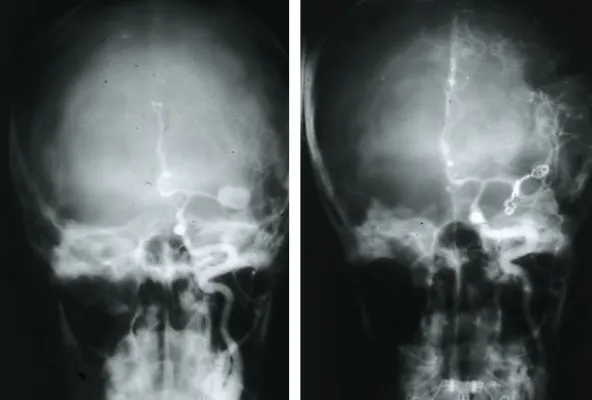
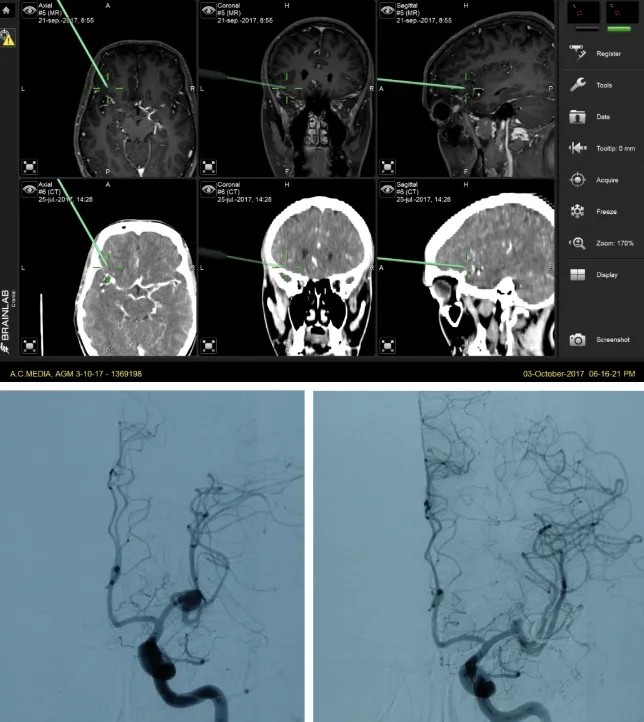
Una vez confirmada la hemorragia, es necesario identificar el aneurisma responsable. Para ello se emplean la angio-TAC (TAC con contraste vascular) y el estudio angiográfico cerebral (arteriografía), que no solo permiten localizar y caracterizar el aneurisma antes de la intervención, sino que también sirven para comprobar que el aneurisma se ha cerrado correctamente tras el tratamiento.
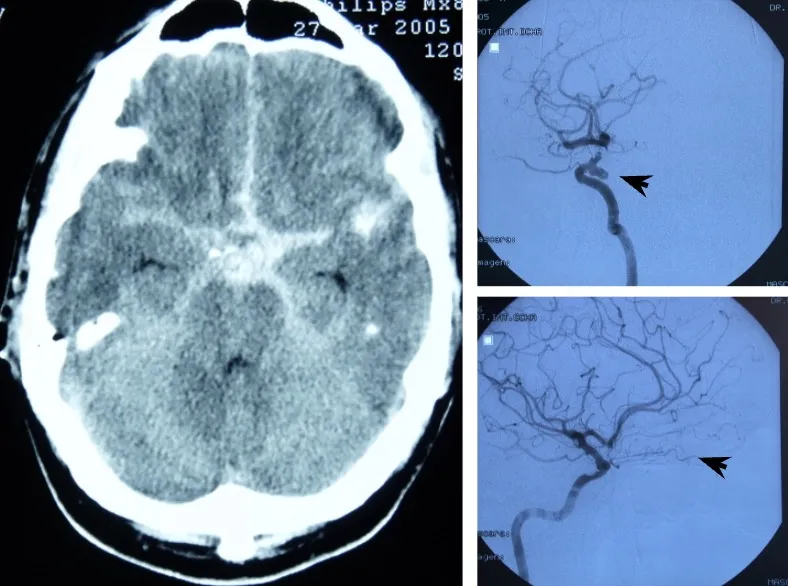
Tratamiento
El código ictus
El tratamiento de la hemorragia cerebral por aneurismas se enmarca dentro del denominado código ictus, un protocolo de actuación urgente que ha supuesto un avance fundamental en la atención al ictus. La neurología ha conseguido que el término «ictus» se difunda entre la población general, de manera similar a como la palabra «infarto» se asocia inmediatamente al corazón: el ictus se asocia al cerebro.
En Madrid, el código ictus se estableció de forma estructurada en 2008 como primera etapa centrada en el ictus isquémico, y posteriormente se incorporó una segunda etapa en 2014 con el tratamiento endovascular. Los dos mensajes fundamentales del código ictus son: el tiempo es cerebro (cada minuto cuenta) y el tratamiento debe realizarse por un equipo multidisciplinario.
El ictus hemorrágico dentro del código ictus
Sin embargo, el ictus hemorrágico ha quedado relativamente relegado dentro de estos protocolos, a pesar de representar el 20-30% de los ictus y ser especialmente devastador. Los pacientes con ictus hemorrágico no se diferencian clínicamente de los isquémicos en las fases iniciales, y aunque las técnicas neuroquirúrgicas han avanzado notablemente, la morbimortalidad de esta patología sigue siendo muy elevada.
El ictus hemorrágico presenta una etiología completamente diferente al isquémico —aneurismas, malformaciones vasculares, hipertensión arterial, uso de anticoagulantes, angiopatías— y requiere tratamientos complejos que pueden involucrar abordajes neurológico-médico, endovascular, neuroquirúrgico e incluso radiocirugía. Por ello, resulta fundamental incluirlo plenamente en el código ictus.
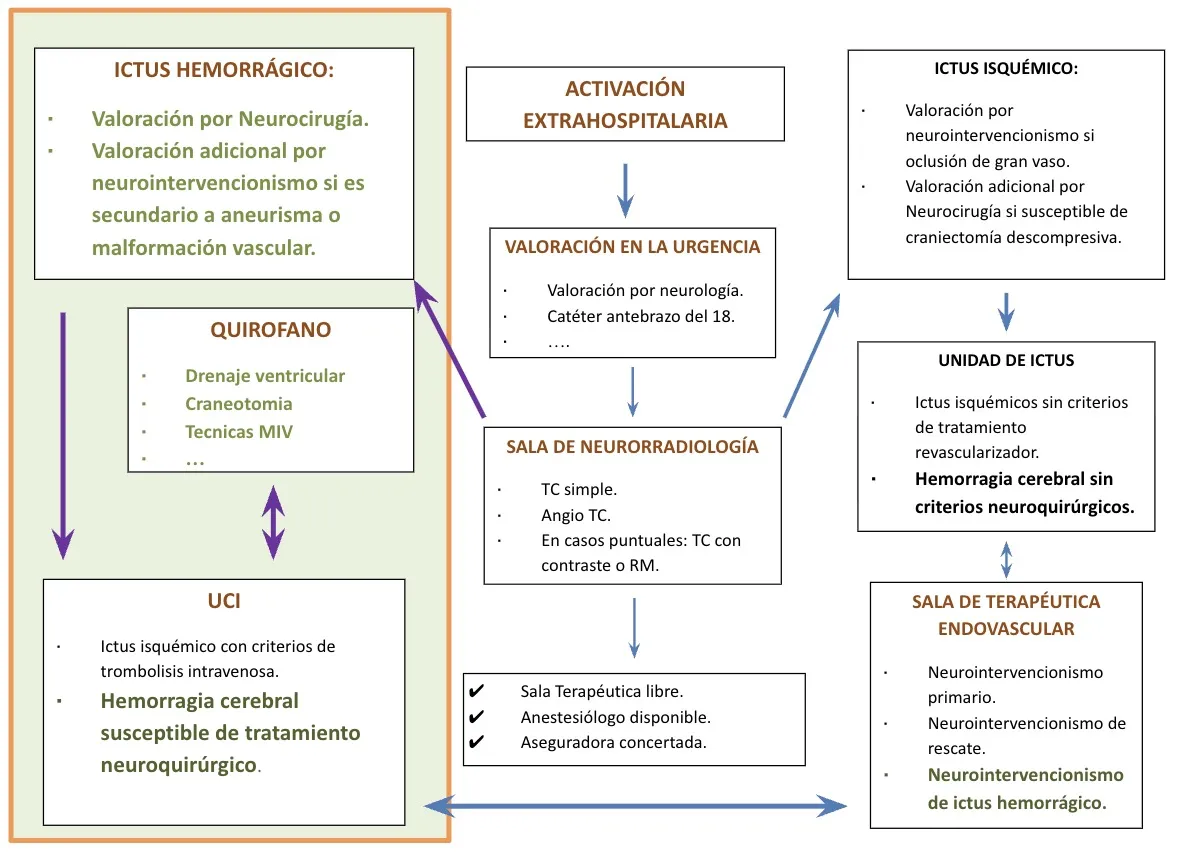
Equipo multidisciplinario
El abordaje integral de la hemorragia cerebral requiere la colaboración de un equipo multidisciplinario que incluya especialistas en neurología, radiología intervencionista, neurorradiología, neurocirugía y neurorradioterapia. El Instituto de Neurociencias Avanzadas de Madrid (INEAMAD), ubicado en el Hospital Nuestra Señora del Rosario, fue pionero en la Comunidad de Madrid en incluir tanto el ictus isquémico como el hemorrágico dentro del código ictus, disponiendo de guardias de 24 horas en todas las especialidades implicadas.
Equipo Código ICTUS – Instituto de Neurociencias Avanzadas de Madrid: INEAMAD
Neurología: Dr. V. Anciones
Radiología Intervencionista: Dr. A. Casasco
Neurorradiología: Dres. E. Vañó y D. Quiñones
Neurocirugía: Dr. R. García de Sola
Neuro-Radioterapia: Dr. R. García Alejo

El protocolo de actuación sigue un algoritmo complejo en el que intervienen todas las especialidades de forma coordinada. Desde la activación extrahospitalaria, pasando por la valoración en urgencias, la realización de pruebas de imagen en la sala de neurorradiología, hasta las decisiones terapéuticas que pueden dirigir al paciente al quirófano, a la sala de terapéutica endovascular, a la UCI o a la unidad de ictus, según las características de cada caso.
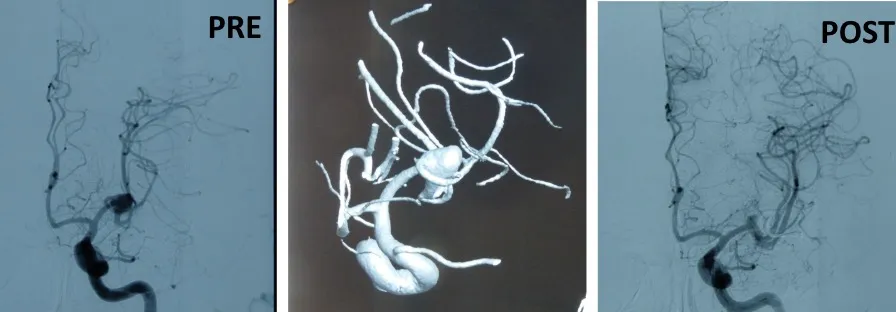
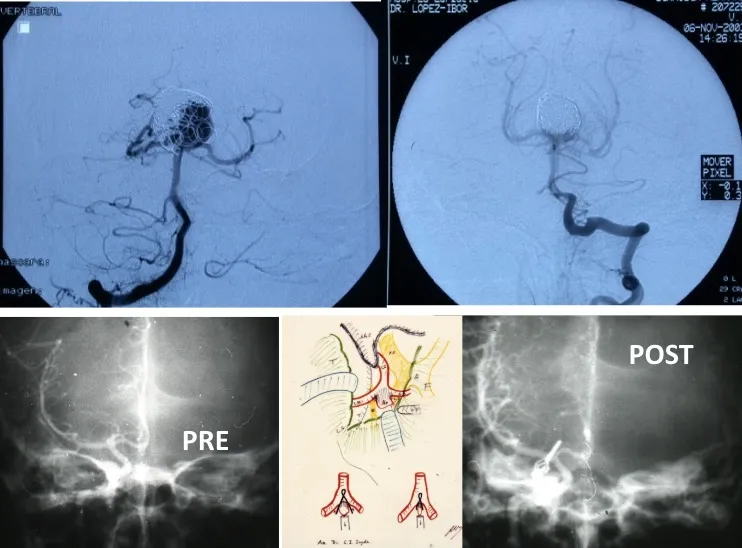
Cierre del aneurisma
El objetivo terapéutico fundamental es el cierre precoz del aneurisma para prevenir el resangrado. Existen dos modalidades principales de tratamiento:
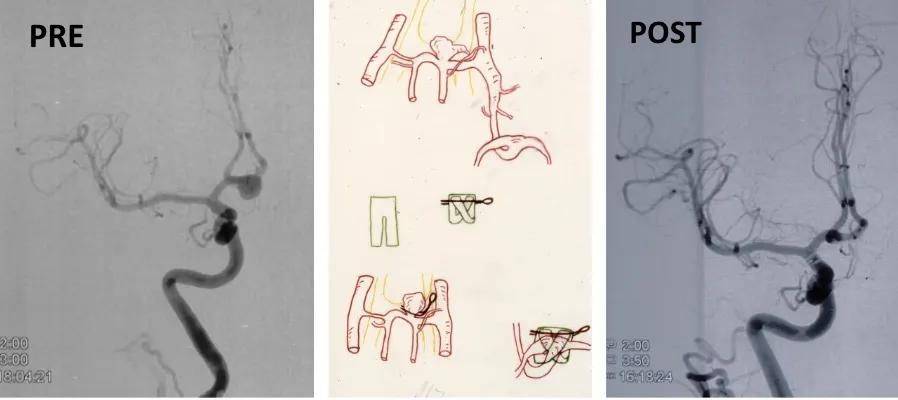
- Embolización endovascular: se introduce un catéter a través de una arteria periférica hasta llegar al aneurisma, donde se depositan espirales (coils) u otros materiales que rellenan el saco aneurismático y lo excluyen de la circulación.
- Cirugía (clipaje): mediante una intervención neuroquirúrgica se coloca un clip metálico en el cuello del aneurisma para cerrarlo definitivamente e impedir que la sangre entre en su interior.
Además del cierre del aneurisma, es necesario tratar las complicaciones asociadas a la hemorragia subaracnoidea, como el vasoespasmo (contracción de las arterias cerebrales que puede producir isquemia secundaria) y la posible hidrocefalia, que puede requerir la colocación de un drenaje ventricular.
Técnica quirúrgica del clipaje
La cirugía de clipaje de un aneurisma cerebral es un procedimiento de alta complejidad técnica que se realiza con ayuda de tecnología avanzada de control intraoperatorio. Los pasos fundamentales de la intervención son:
- Apertura de la cisura de Silvio (separación del lóbulo temporal del frontal) para acceder a la base del cerebro.
- Disección y exposición del aneurisma.
- Realización de una angiografía intraoperatoria y control con fluorescencia de verde indocianina para visualizar el flujo sanguíneo en tiempo real.
- Clipaje temporal de la arteria portadora del aneurisma para reducir la presión y facilitar la colocación segura del clip definitivo.
- Clipaje definitivo del aneurisma.
- Control mediante fluorescencia de verde indocianina y angiografía para verificar el cierre correcto del aneurisma y la permeabilidad de las arterias adyacentes.
- Cierre de la intervención.
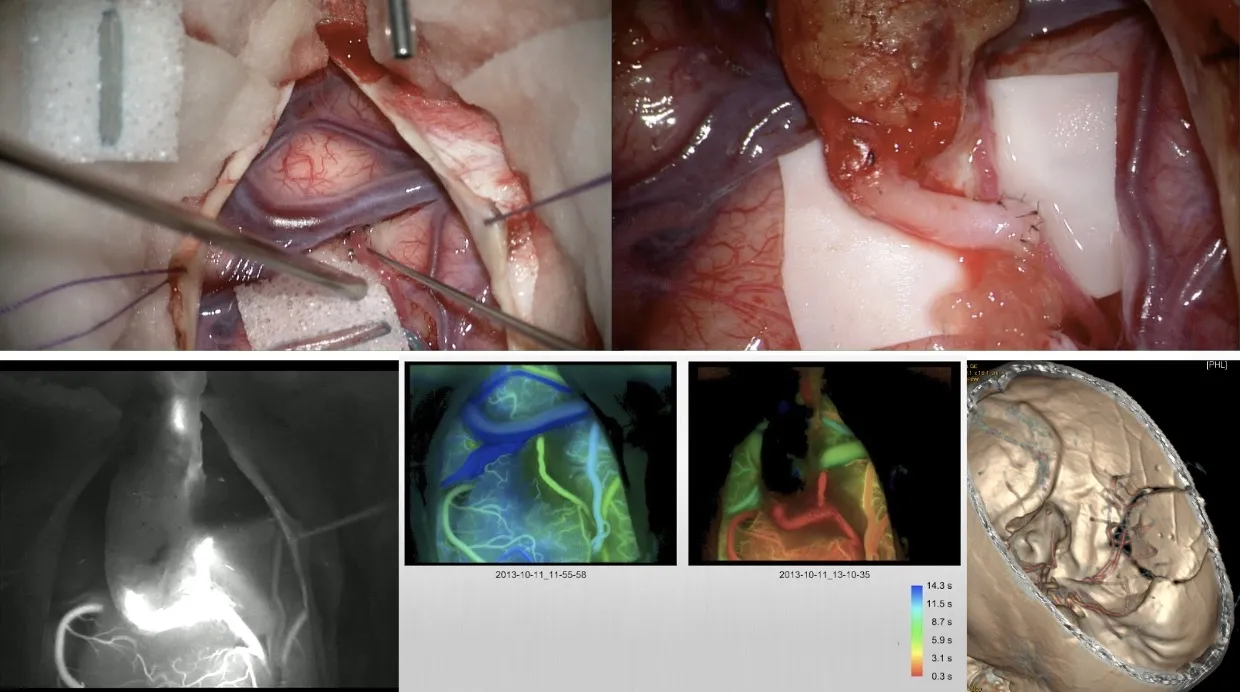
El neuronavegador es otra herramienta fundamental que permite localizar con absoluta precisión la posición del aneurisma y planificar la ruta quirúrgica más segura para acceder a él, integrando las imágenes de TAC y resonancia magnética preoperatorias con la realidad anatómica del paciente durante la intervención.
Video que muestra una intervención quirúrgica de un aneurisma cerebral por el equipo del Dr. García de Sola

Conclusión
La hemorragia cerebral por rotura de aneurismas constituye una de las patologías neurológicas más graves, con una morbimortalidad que sigue siendo elevada. Sin embargo, cada cinco o diez años se produce un salto cualitativo en los resultados, gracias a la implementación del código ictus —que en ciudades como Madrid funciona de manera muy eficaz—, a la existencia de equipos multidisciplinarios que integran todas las especialidades necesarias y al desarrollo de técnicas de neurocirugía mínimamente invasiva.
Los avances en la tecnología del quirófano inteligente, con herramientas como la fluorescencia con verde indocianina, la angiografía intraoperatoria y el neuronavegador, permiten realizar intervenciones cada vez menos agresivas y más precisas, mejorando progresivamente los resultados quirúrgicos.
El diagnóstico precoz, la atención urgente coordinada y el cierre temprano del aneurisma siguen siendo los pilares fundamentales para mejorar el pronóstico de los pacientes que sufren esta devastadora patología.