Video-charla del Dr. García de Sola sobre el tratamiento neuroquirúrgico del dolor: fisiopatología y clínica – Parte I

Tratamiento neuroquirúrgico del dolor: fisiopatología y clínica

El tratamiento neuroquirúrgico del dolor requiere comprender primero los mecanismos fisiopatológicos y las manifestaciones clínicas de este complejo fenómeno. El dolor es una experiencia universal que se nos impone, molesta y escapa a nuestro control. Como afirmaba René Leriche, pionero de la cirugía del dolor, «no hay más que un dolor que sea fácil de soportar y es el dolor de los demás». Este síntoma ha sido objeto de estudio desde múltiples disciplinas: filosofía, psiquiatría, neurología, fisiología y anatomía.
El dolor es inherente a la naturaleza humana, presentándose como la contraposición natural al placer. Aunque puede enriquecer la personalidad, cumple fundamentalmente una función protectora esencial para la supervivencia y evolución de las especies. Desde la perspectiva médica, el dolor puede manifestarse como un síntoma transitorio, como parte de un síndrome complejo, o incluso convertirse en una enfermedad per se cuando se cronifica. Este último concepto, desarrollado por John Bonica, resulta crucial: el dolor crónico se caracteriza por su estabilidad, persistencia y capacidad de alterar profundamente el comportamiento del paciente.
El sistema nervioso central posee circuitos específicos donde el dolor se procesa y modula. Desde las astas posteriores medulares hasta la corteza cerebral, pasando por el tálamo y el sistema límbico, existe una compleja red neuronal que transmite y regula las sensaciones dolorosas. Comprender estos mecanismos fisiopatológicos es fundamental para diseñar estrategias terapéuticas efectivas, ya sean farmacológicas, invasivas o neuroquirúrgicas. La clasificación adecuada del dolor en nociceptivo o neuropático, agudo o crónico, benigno o maligno, determina el abordaje terapéutico más apropiado para cada paciente.
Rafael García de Sola
Director de la Cátedra UAM «Innovación en Neurocirugía»
Jefe del Servicio de Neurocirugía
Hospital Ntra. Sra. del Rosario
Madrid
Concepto de dolor
El dolor es una experiencia compleja que todos hemos sufrido en algún momento de nuestra vida. Se nos impone, molesta y no podemos controlarlo completamente. Como decía el cirujano francés René Leriche a principios del siglo XX: «no hay más que un dolor que sea fácil de soportar y es el dolor de los demás». Esta frase refleja una verdad profunda sobre la naturaleza inherentemente personal e intransferible del dolor.

Alrededor del dolor se construyen infinidad de teorías desde diferentes disciplinas. La filosofía, psiquiatría, neurología, fisiología, anatomía y hasta la teología han debatido durante siglos sobre sus aspectos fundamentales, convirtiendo al dolor en un objeto de estudio multidisciplinar que requiere la integración de múltiples perspectivas para su comprensión completa.
El dolor como elemento inherente a la condición humana
El dolor es inherente a la naturaleza humana, formando parte inseparable de la experiencia vital. Existe una contraposición natural entre dolor y placer que define gran parte de nuestra percepción del mundo. Paradójicamente, aunque resulte difícil de aceptar, el dolor puede enriquecer la personalidad al obligarnos a desarrollar mecanismos de afrontamiento y resiliencia.
Desde una perspectiva biológica, el dolor cumple una función protectora fundamental. Actúa como un sistema de alarma que advierte de posibles daños tisulares, permitiendo respuestas defensivas que han sido cruciales para la supervivencia y evolución de las especies. Sin esta capacidad de percibir el dolor, los organismos estarían expuestos a lesiones graves sin posibilidad de reacción preventiva.
Clasificaciones del concepto de dolor
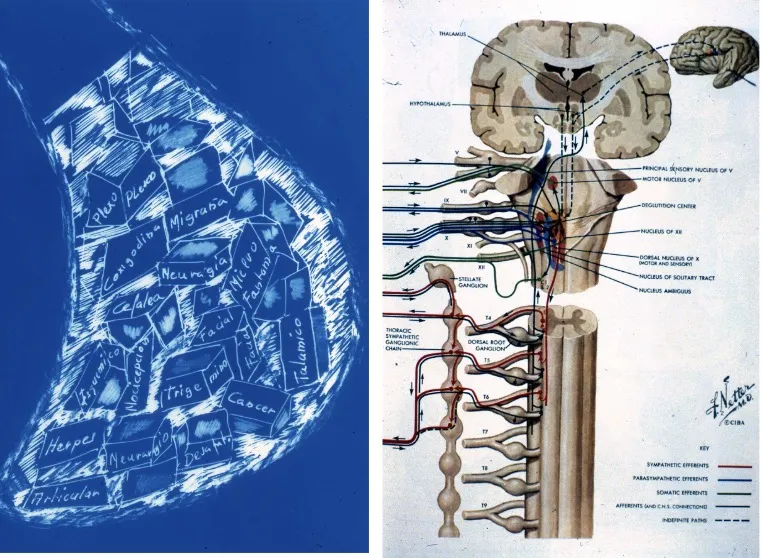
Desde el punto de vista médico, el dolor puede conceptualizarse de tres formas diferentes, cada una con importantes implicaciones terapéuticas. En primer lugar, el dolor como síntoma representa una manifestación de alguna patología subyacente, funcionando como señal de alerta de que algo está dañando los tejidos.
En segundo lugar, cuando el dolor se presenta como parte de un cuadro clínico más amplio, hablamos de dolor como síndrome. En este contexto, el dolor se integra dentro de un conjunto de manifestaciones de una enfermedad específica, requiriendo un enfoque terapéutico que contemple todos los aspectos del proceso patológico.
Finalmente, y quizá el concepto más relevante introducido por John Bonica, el dolor puede constituir una enfermedad en sí mismo. Esto ocurre cuando el dolor se cronifica, adquiere estabilidad temporal y produce alteraciones importantes en el comportamiento del paciente. En estos casos, el dolor persiste incluso después de que la causa original haya desaparecido, transformándose en un problema médico independiente.
Esta última conceptualización resulta crucial porque implica que el sistema nervioso central puede desarrollar cambios estructurales y funcionales que perpetúan el dolor. Cada tipo de dolor representa una enfermedad precisa, con su propia etiología, patogenia, manifestaciones clínicas, criterios diagnósticos y opciones terapéuticas diferenciadas.
Bases neurofisiológicas del dolor
La comprensión de los mecanismos neurofisiológicos del dolor ha avanzado considerablemente, revelando una organización anatómica y funcional extraordinariamente compleja. El procesamiento de las señales dolorosas comienza en la periferia y asciende a través de múltiples estaciones hasta alcanzar la conciencia en la corteza cerebral.
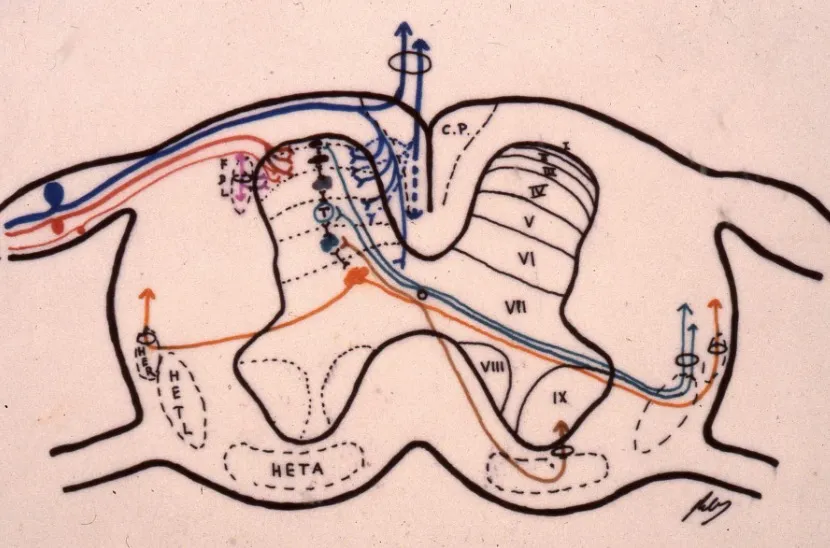
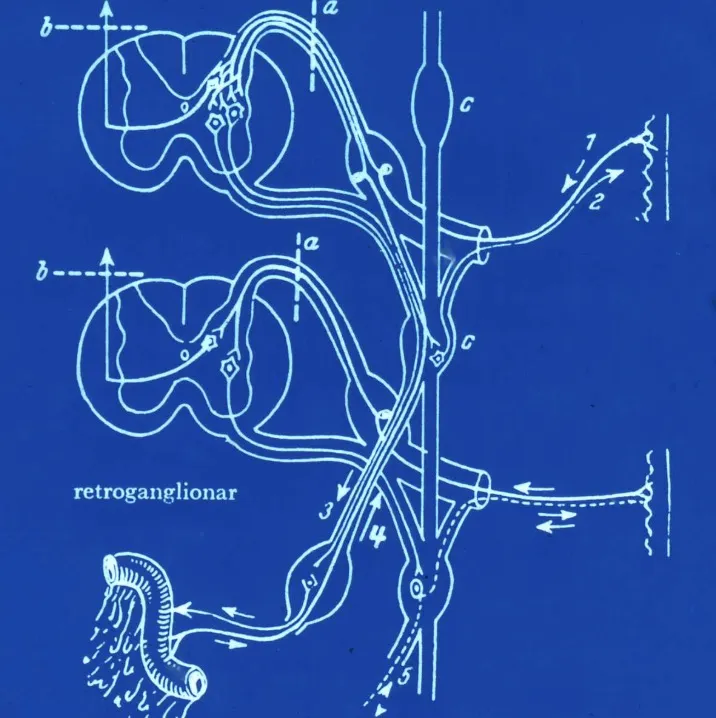
Asta posterior medular: primer relé nociceptivo
El primer relé fundamental donde se inicia el procesamiento de las sensaciones dolorosas se localiza en el asta posterior de la médula espinal. Esta estructura presenta una compleja organización neuronal distribuida en láminas (I-IV de Rexed) que reciben y modulan la información nociceptiva proveniente de la periferia.
A través de las raíces posteriores llega la información sensitiva transportada por diferentes tipos de fibras nerviosas. Las fibras Aδ y C son las principales transmisoras del dolor y la temperatura. Estas fibras hacen sinapsis con neuronas del asta posterior, donde comienza la primera modulación de la señal dolorosa. También llegan fibras Aβ, de mayor diámetro, que transportan información táctil y propioceptiva.
En este primer relevo medular intervienen diversos neurotransmisores. La sustancia P desempeña un papel crucial en la transmisión de señales nociceptivas. Además, existen fibras descendentes que llegan desde centros superiores a través de los cordones posteriores, ejerciendo una función moduladora sobre la transmisión del dolor. Esta modulación se realiza mediante receptores opiáceos endógenos, que constituyen un sistema natural de control del dolor.
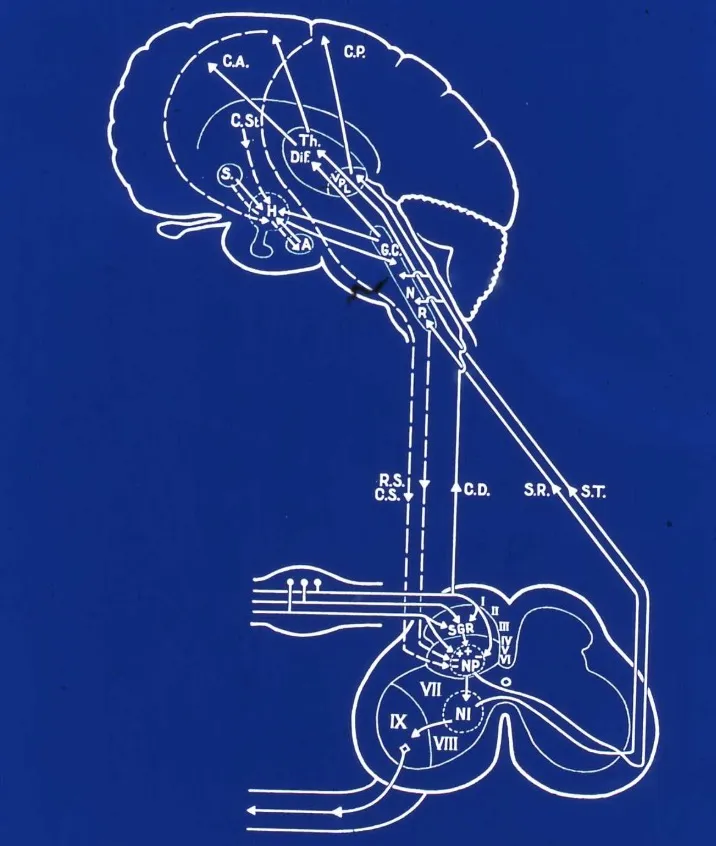
Vías ascendentes del dolor
Desde el asta posterior medular, la información dolorosa asciende hacia el cerebro a través de dos sistemas principales que procesan aspectos diferentes de la experiencia dolorosa: el componente sensitivo-discriminativo y el componente afectivo-emocional.
Componente sensitivo-discriminativo
El componente sensitivo-discriminativo del dolor permite localizar con precisión dónde duele, identificar la intensidad y caracterizar el tipo de dolor. Este aspecto cognitivo del dolor depende de dos vías principales que transportan información diferenciada.
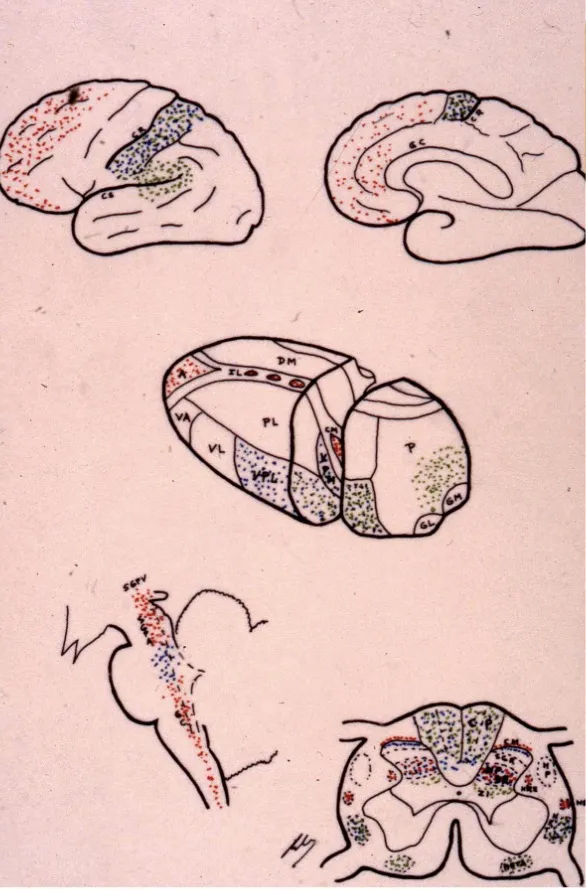
La vía espino-talámica constituye el tracto más importante para la transmisión del dolor agudo y la sensación térmica. Las neuronas del asta posterior envían sus axones que cruzan la línea media a través de la decusación periependimaria, ascendiendo por el cuadrante anterolateral contralateral de la médula. Estas fibras alcanzan el núcleo ventral posterolateral (VPL) y el complejo posterior (Po) del tálamo, desde donde se proyectan a la corteza sensitiva primaria y secundaria.
Por su parte, los cordones posteriores transportan información sobre el tacto discriminativo, la vibración y la propiocepción. A diferencia del tracto espino-talámico, estas fibras ascienden ipsilateralmente (sin cruzar) hasta el bulbo raquídeo, donde realizan sinapsis en los núcleos grácil y cuneiforme. Desde allí, las fibras cruzan y continúan hasta el tálamo.
Ambas vías convergen finalmente en el tálamo, que actúa como estación de relé crucial antes de proyectarse a la corteza sensitiva. La integración de estas dos vías permite una percepción completa y discriminativa del dolor, identificando su localización exacta, intensidad y características específicas.
Componente afectivo-emocional
El componente afectivo-emocional del dolor representa el aspecto desagradable y sufriente de la experiencia dolorosa. Este componente se transmite a través de vías más difusas y multisinápticas, con múltiples relés neuronales que generan una transmisión más lenta pero de mayor complejidad emocional.
El tracto espino-reticular proyecta desde las láminas V-VIII del asta posterior hacia la sustancia reticular del tronco encefálico. Esta vía no permite localizar el dolor con precisión, pero actúa sobre mecanismos viscerales y autonómicos, generando respuestas vegetativas como taquicardia, hipertensión y sudoración ante el dolor.
El tracto espino-mesencefálico proyecta hacia la sustancia gris periacueductal (PAG), una estructura crucial en la modulación del dolor. Aunque presenta cierta distribución somatotópica, su función principal es activar sistemas descendentes de control del dolor.
Adicionalmente, el tracto espino-talámico ventral y el sistema ascendente multisináptico proyectan hacia el tálamo medial y posteriormente al hipotálamo y el sistema límbico. Estas estructuras integran la dimensión emocional del dolor, generando las sensaciones de sufrimiento, ansiedad y depresión que frecuentemente acompañan al dolor crónico.
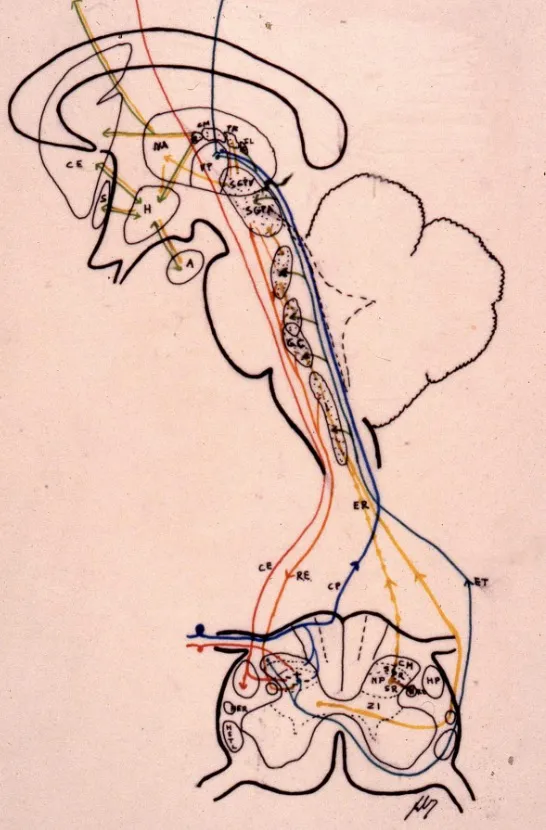
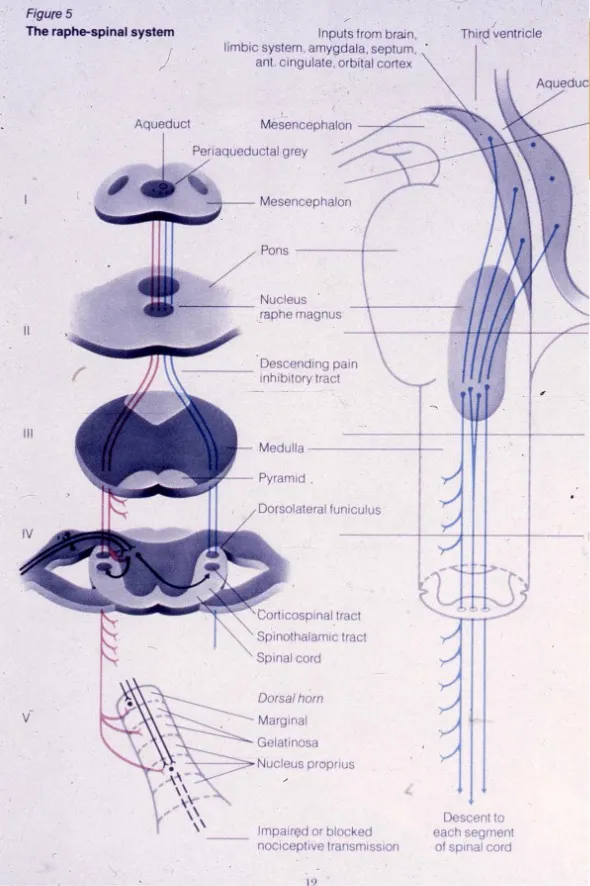
Vías descendentes: sistemas de modulación del dolor
El sistema nervioso no solo recibe pasivamente señales de dolor, sino que posee mecanismos activos para modular e inhibir la transmisión nociceptiva. Las vías descendentes constituyen sistemas endógenos de control del dolor que pueden atenuar significativamente la percepción dolorosa.
Desde el córtex cerebral y el diencéfalo descienden fibras que discurren por los cordones posteriores de la médula espinal. Estas fibras modulan directamente la actividad neuronal en el asta posterior, controlando la entrada de información nociceptiva desde la periferia.
El tracto retículo-espinal representa otra vía descendente fundamental que se origina en la sustancia gris periacueductal (PAG) del mesencéfalo. Esta estructura recibe información de centros superiores y proyecta hacia el núcleo magno del rafe en el bulbo raquídeo, desde donde descienden fibras que utilizan serotonina como neurotransmisor.
Estos sistemas descendentes actúan mediante la liberación de neurotransmisores inhibitorios y la activación de receptores opiáceos endógenos en el asta posterior medular. Las endorfinas, encefalinas y dinorfinas constituyen opioides endógenos que se unen a receptores mu, delta y kappa, generando analgesia natural. Este sistema explica fenómenos como la reducción del dolor en situaciones de estrés extremo o la eficacia de técnicas de modulación cognitiva del dolor.
Tipos de dolor
La clasificación del dolor resulta fundamental para establecer estrategias terapéuticas apropiadas. Desde el punto de vista fisiopatológico, se distinguen dos grandes categorías: el dolor nociceptivo y el dolor neuropático, cada uno con mecanismos, características clínicas y respuestas terapéuticas diferentes.
Dolor nociceptivo: dolor por exceso de nocicepción
El dolor nociceptivo se produce cuando existe un estímulo nocivo que activa los receptores del dolor (nociceptores) de forma normal. Este tipo de dolor indica que existe una agresión tisular real y cumple una función protectora esencial.
Dolor fisiológico agudo
El dolor agudo representa la forma fisiológica de dolor nociceptivo. Se caracteriza por ser transitorio y reversible, actuando como sistema de alarma que avisa de la existencia de un daño tisular potencial o real. Este tipo de dolor desencadena respuestas coordinadas y adaptativas del organismo.
La respuesta de retirada constituye la primera reacción ante un estímulo doloroso agudo. Por ejemplo, al quemarse, se produce una reacción refleja automática de alejamiento antes incluso de que el dolor alcance la consciencia plena. Este reflejo medular protege al organismo de lesiones mayores.
Simultáneamente se activan respuestas autonómicas, incluyendo hipertensión arterial, taquicardia y liberación de hormonas de estrés. El eje hipotálamo-hipofisario se activa, preparando al organismo para responder a la amenaza. Además, el dolor agudo induce inmovilización de la zona afectada, favoreciendo la curación al evitar movimientos que puedan agravar la lesión.
El dolor agudo responde bien a analgésicos convencionales y desaparece cuando se resuelve la causa que lo produce. Este tipo de dolor transmite información a través de las vías ascendentes fisiológicas que hemos descrito, principalmente el sistema espino-talámico lateral.
Dolor patológico crónico
El dolor nociceptivo puede cronificarse cuando persiste la causa que lo genera. A diferencia del dolor agudo, el dolor crónico se mantiene en el tiempo, frecuentemente durante meses o años. Aunque sigue avisando de que existe un daño tisular, pierde su carácter protector para convertirse en una fuente de sufrimiento.
Un ejemplo típico es el dolor por compresión radicular en hernias discales que no se resuelven. Mientras persista la compresión de la raíz nerviosa, el dolor se mantendrá. Otros ejemplos incluyen el dolor oncológico, las artropatías degenerativas y las enfermedades inflamatorias crónicas.
El dolor crónico nociceptivo mantiene las mismas vías de transmisión que el dolor agudo, pero su persistencia puede inducir cambios en el procesamiento central del dolor, fenómeno conocido como sensibilización central. Esto puede hacer que el dolor persista incluso después de resolver la causa original.
Dolor neuropático: dolor por desaferentización
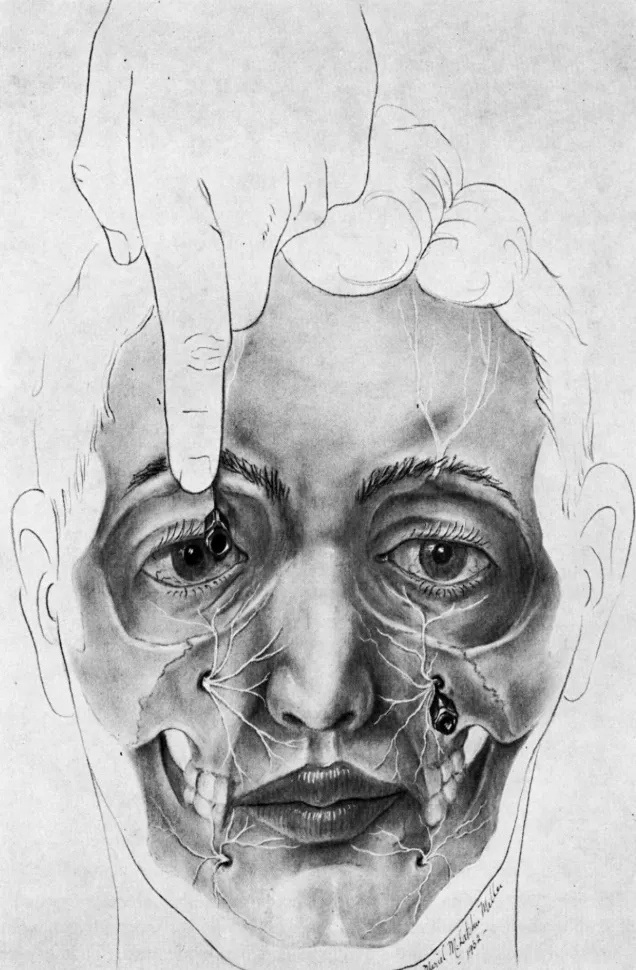
El dolor neuropático representa una forma patológica de dolor que se origina por lesión o disfunción del sistema nervioso periférico o central. A diferencia del dolor nociceptivo, no existe un estímulo nocivo externo que lo justifique, sino que el propio sistema nervioso dañado genera señales dolorosas aberrantes.
Concepto y características del dolor neuropático
El dolor neuropático se define como aquel iniciado o causado por una lesión primaria o disfunción del sistema nervioso. Esta definición subraya que el origen del dolor está en el daño neuronal mismo, no en la estimulación de receptores normales del dolor.
Este tipo de dolor presenta características clínicas distintivas que lo diferencian del dolor nociceptivo. En primer lugar, resulta paradójico: el paciente experimenta dolor intenso en zonas donde simultáneamente existe déficit de la sensibilidad normal. Esta coexistencia de síntomas positivos (dolor) y negativos (hipoestesia) constituye un hallazgo característico.
Los síntomas positivos incluyen varias manifestaciones específicas. Las parestesias se describen como sensaciones anormales espontáneas, frecuentemente de hormigueo o corriente eléctrica. Las hiperestesias representan una sensibilidad exagerada al tacto. Las disestesias son sensaciones desagradables provocadas por estímulos normalmente inocuos.
El dolor espontáneo neuropático adopta diversas cualidades que los pacientes describen de forma característica: sensación de pinchazos, quemazón intensa, dolor urente o descargas lancinantes. La alodinia constituye un fenómeno especialmente incapacitante: el simple roce de la ropa o el aire puede desencadenar dolor intenso. La hiperalgesia significa que estímulos levemente dolorosos provocan respuestas desproporcionadas. La hiperpatía implica que el dolor persiste después de cesar el estímulo, con umbral elevado pero respuesta exagerada.
Otra característica distintiva es que el dolor empeora con estímulos repetitivos, un fenómeno conocido como sumación temporal. Estímulos que inicialmente eran tolerables se vuelven progresivamente más dolorosos con la repetición.
Mecanismos fisiopatológicos del dolor neuropático
Los mecanismos que generan y mantienen el dolor neuropático son múltiples y complejos, operando en diferentes niveles del sistema nervioso. Comprender estos mecanismos resulta crucial para diseñar estrategias terapéuticas efectivas.
A nivel periférico se producen varios fenómenos patológicos. Ocurre una reorganización de las fibras nerviosas, con brotación anormal de terminaciones. Los receptores desarrollan actividad espontánea, disparando potenciales de acción sin estímulo externo. Además, disminuye el umbral de excitación, generando hiperexcitabilidad neuronal. Un fenómeno peculiar es el acoplamiento con el sistema nervioso simpático, explicando la eficacia de los bloqueos simpáticos en ciertos tipos de dolor neuropático.
A nivel espinal se observa reorganización anatómica en el asta posterior, particularmente en la lámina II. Las fibras Aβ, normalmente relacionadas con el tacto, establecen conexiones aberrantes con neuronas nociceptivas, explicando la alodinia. Se produce un fenómeno de regeneración desorganizada y aumento de la sensibilización central fisiológica. Crucialmente, existe pérdida del control inhibitorio endógeno, permitiendo que señales que normalmente serían filtradas alcancen niveles superiores.
A nivel supraespinal se produce un aumento de las vías facilitadoras descendentes, en contraste con la disminución de la capacidad inhibitoria. Ocurre reorganización a nivel talámico y en la corteza cerebral, con cambios en los mapas somatosensoriales. Estas modificaciones plásticas pueden perpetuar el dolor incluso después de resolver la lesión inicial.
Síndromes y enfermedades dolorosas
El dolor puede manifestarse en múltiples contextos clínicos, desde síndromes miofasciales hasta dolor oncológico. La comprensión de cada síndrome específico permite un abordaje terapéutico más preciso y efectivo.
Síndromes miofasciales
Los síndromes miofasciales representan una causa frecuente de dolor crónico, afectando principalmente al sistema musculoesquelético. Las lumbalgias constituyen la manifestación más prevalente, afectando a una gran proporción de la población en algún momento de su vida. El síndrome de cirugía fallida de columna (failed back syndrome) representa un desafío terapéutico particular, donde persiste el dolor después de intervenciones quirúrgicas en la columna vertebral.
La fibromialgia constituye un síndrome complejo caracterizado por dolor musculoesquelético generalizado, fatiga, alteraciones del sueño y puntos gatillo específicos. Aunque no existe una lesión estructural demostrable, los pacientes experimentan dolor intenso y discapacitante que responde de forma limitada a tratamientos convencionales.
Dolor craneofacial
El dolor craneofacial engloba diversas entidades con mecanismos y tratamientos diferenciados. La neuralgia esencial del trigémino se caracteriza por episodios de dolor facial lancinante, intensísimo, de segundos de duración, desencadenado por estímulos táctiles en zonas gatillo. Responde característicamente a carbamazepina, aunque puede requerir tratamiento neuroquirúrgico cuando falla el manejo farmacológico.
La neuralgia facial atípica presenta características más difusas, con dolor continuo menos bien localizado, que no responde a carbamazepina. La neuralgia postherpética constituye una complicación del herpes zóster, con dolor neuropático persistente en el territorio del nervio afectado. La analgesia dolorosa de la cara representa una forma de dolor neuropático central, frecuentemente iatrogénico tras procedimientos ablativos.
Las cefaleas constituyen otro grupo importante, incluyendo migraña, cefalea tensional y cefalea en racimos, cada una con características clínicas y opciones terapéuticas específicas. Otras neuralgias incluyen la del nervio occipital, glosofaríngeo y nervio intermediario.
Síndromes por desaferentización
El miembro doloroso fantasma representa un fenómeno fascinante donde el paciente experimenta dolor en una extremidad amputada. Este dolor neuropático central resulta del proceso de reorganización cortical tras la amputación. El arrancamiento del plexo braquial, frecuentemente por traumatismos de alta energía, genera dolor neuropático intenso por avulsión de las raíces nerviosas.
La sección medular traumática puede asociarse con dolor neuropático que aparece meses o años después de la lesión, tanto a nivel de la lesión como por debajo de ella. El síndrome de Dejerine-Roussy, secundario a lesiones talámicas vasculares, produce un dolor central característico con componente quemante y dificultad extrema para el tratamiento.
Los dolores postquirúrgicos constituyen una complicación reconocida de diversas intervenciones. La toracotomía, mastectomía y cirugía de hernia inguinal pueden generar dolor neuropático crónico por lesión de nervios intercostales o periféricos.
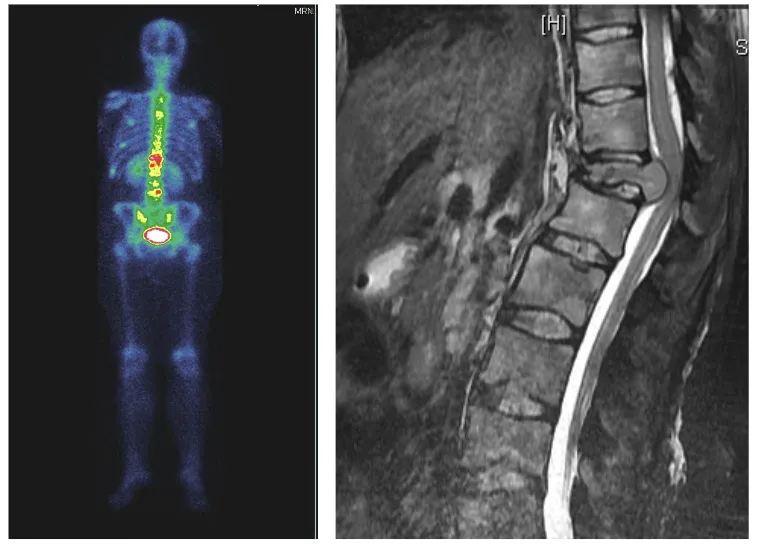
Dolor en cáncer
El dolor oncológico presenta características mixtas, combinando frecuentemente componentes nociceptivos y neuropáticos. La invasión tumoral directa genera dolor nociceptivo por destrucción tisular y liberación de mediadores inflamatorios. La compresión o infiltración de estructuras nerviosas añade un componente neuropático.
Con el aumento de la supervivencia en muchos tipos de cáncer, el control del dolor oncológico se ha convertido en un aspecto crucial de la calidad de vida. Los tratamientos oncológicos (quimioterapia, radioterapia) pueden generar también síndromes dolorosos iatrogénicos, como la neuropatía periférica por quimioterapia o la plexopatía postradioterapia.
El abordaje del dolor oncológico requiere un enfoque multimodal, combinando analgésicos según la escalera de la OMS, técnicas intervencionistas cuando esté indicado, y considerando la expectativa de vida del paciente en la selección de tratamientos.
Diagnóstico del dolor
El diagnóstico correcto del tipo de dolor resulta fundamental para seleccionar el tratamiento más apropiado. Existen varios criterios de clasificación que guían la toma de decisiones terapéuticas.
Clasificación temporal: agudo o crónico
La primera distinción importante se basa en la expectativa de curación. El dolor agudo generalmente presenta una causa identificable y se espera que desaparezca cuando se resuelva el proceso subyacente. El dolor crónico, por definición, persiste más allá del tiempo esperado de curación, frecuentemente considerándose crónico cuando supera los tres a seis meses de duración.
Esta distinción no es meramente temporal, sino que implica diferentes mecanismos fisiopatológicos, impacto psicológico y aproximaciones terapéuticas. El dolor crónico frecuentemente desarrolla componentes de sensibilización central y alteraciones psicológicas que requieren abordajes multidisciplinares.
Clasificación pronóstica: benigno o maligno
Esta clasificación se basa en la expectativa de vida del paciente. El dolor benigno no amenaza la supervivencia a corto plazo, permitiendo planificar tratamientos a largo plazo y considerar opciones terapéuticas que requieren tiempo para mostrar eficacia. El dolor maligno, típicamente asociado a cáncer, requiere considerar la expectativa de vida en las decisiones terapéuticas, priorizando la calidad de vida y el alivio rápido del sufrimiento.
Clasificación fisiopatológica: nociceptivo o neuropático
Esta distinción resulta crucial porque determina fundamentalmente las opciones terapéuticas. El dolor nociceptivo indica exceso de estimulación de receptores del dolor por daño tisular real. El dolor neuropático implica lesión establecida del sistema nervioso periférico o central.
La combinación de estas tres clasificaciones permite caracterizar con precisión el dolor de cada paciente: agudo o crónico, benigno o maligno, nociceptivo o neuropático. Esta caracterización guía la selección del tratamiento, desde opciones farmacológicas hasta técnicas intervencionistas o neuroquirúrgicas.
Clínica del dolor: los cuatro estadios de Hendler
Nelson Hendler describió una clasificación evolutiva del dolor crónico en cuatro estadios que resulta extraordinariamente útil para comprender la progresión natural del dolor y sus implicaciones psicológicas y sociales. Esta clasificación permite identificar en qué fase se encuentra cada paciente y anticipar las necesidades terapéuticas.
Estadio I: dolor agudo (menos de 2 meses)
En esta fase inicial, el paciente presenta dolor de reciente aparición, generalmente con una causa identificable. No existen trastornos psicológicos asociados, el paciente mantiene la esperanza de curarse y espera que el tratamiento resuelva su problema. El dolor responde habitualmente a analgésicos convencionales.
Las vías del dolor implicadas son las fisiológicas, principalmente el sistema espino-talámico lateral y los cordones posteriores. El paciente mantiene su estructura social, laboral y familiar sin alteraciones significativas. Esta fase representa el dolor en su función protectora original.
Estadio II: dolor subagudo (2 a 6 meses)
Cuando el dolor persiste entre dos y seis meses sin resolución, comienzan a aparecer las primeras alteraciones psicológicas. El paciente desarrolla distress emocional y somatización. La ansiedad se hace presente, acompañada de irritabilidad e insomnio. Se inicia un proceso de aislamiento social y disminuye la actividad sexual.
El paciente consume sedantes y analgésicos con mayor frecuencia, aunque todavía mantiene la esperanza de que el dolor cederá. Empieza a experimentar frustración con los tratamientos que no logran resolver su problema. A pesar de estos cambios, las vías del dolor implicadas siguen siendo las fisiológicas tradicionales.
Estadio III: dolor crónico (6 meses a 8 años)
Este estadio representa la cronificación completa del dolor. El paciente desarrolla depresión y angustia significativas. Aparece hostilidad hacia los médicos y cuidadores, consecuencia de múltiples fracasos terapéuticos. El paciente se siente incomprendido y abandona progresivamente el ámbito familiar, social y laboral.
Desde el punto de vista neurofisiológico, se activan vías diferentes a las del dolor agudo. Las vías paleo-espino-talámicas, la sustancia reticular, el hipotálamo y el sistema límbico se involucran en el procesamiento del dolor. Esta activación explica la profunda integración del dolor con aspectos emocionales y el componente de sufrimiento que caracteriza esta fase.
El dolor deja de ser solo una sensación física para convertirse en una experiencia que domina completamente la vida del paciente. La personalidad se modifica, la capacidad funcional se deteriora dramáticamente y la calidad de vida se ve severamente comprometida.
Estadio IV: dolor hipercrónico (3 a 12 años)
Sorprendentemente, después de años de sufrimiento intenso, muchos pacientes experimentan una adaptación curiosa. Aprenden a convivir con el dolor, aunque no lo aceptan completamente. El hallazgo más llamativo es que el paciente abandona espontáneamente los tratamientos, habiendo comprendido que ninguna intervención logrará eliminar su dolor.
Paradójicamente, en esta fase el paciente recupera aspectos de su vida que había abandonado: reintegra su núcleo familiar, vuelve a participar en actividades sociales y, en algunos casos, retorna al trabajo. La depresión y el insomnio mejoran significativamente. El propio sistema nervioso parece encontrar mecanismos de adaptación que permiten funcionar a pesar del dolor persistente.
Esta fase tiene importantes implicaciones terapéuticas. No significa condenar al paciente a sufrir durante años, sino reconocer que el sistema nervioso posee capacidades de adaptación que pueden facilitarse mediante abordajes psicológicos y rehabilitadores. En ciertos tipos de dolor refractario, ayudar al paciente a alcanzar este estadio de adaptación puede representar un objetivo terapéutico realista.
El dolor como síntoma, síndrome y enfermedad

Desde el punto de vista diagnóstico y terapéutico, resulta fundamental distinguir tres formas en que el dolor puede manifestarse, cada una con implicaciones diferentes para el manejo clínico.
El dolor como síntoma
Cuando el dolor funciona como síntoma, actúa como señal de alarma de un proceso patológico subyacente. Su intensidad es subjetiva, por lo que se utilizan escalas de dolor para cuantificar la experiencia del paciente. El tratamiento se dirige fundamentalmente a la causa subyacente, siendo el control del dolor sintomático un objetivo secundario importante pero no el principal.
El dolor como síndrome
En muchas enfermedades, el dolor forma parte de un conjunto más amplio de manifestaciones clínicas. El dolor oncológico constituye un ejemplo paradigmático, donde coexisten dolor, síntomas constitucionales, efectos de los tratamientos y aspectos psicológicos. La isquemia de miembros inferiores presenta dolor junto con otros signos de hipoperfusión tisular. Los infartos talámicos generan no solo dolor central sino también déficits sensitivos y motores asociados.
En estos casos, el tratamiento debe abordar todos los componentes del síndrome, no solamente el dolor. La aproximación multidisciplinar resulta particularmente importante en estos contextos.
El dolor como enfermedad
Este concepto, desarrollado principalmente por John Bonica, resulta crucial en medicina del dolor. Cuando la enfermedad que originó el dolor se ha resuelto pero el dolor persiste, estamos ante el dolor como entidad nosológica independiente. La neuralgia postherpética ejemplifica perfectamente esta situación: la infección viral ha desaparecido, pero el dolor neuropático permanece como único problema.
La neuralgia del trigémino representa otro ejemplo clásico donde no existe enfermedad subyacente demostrable, siendo el dolor mismo la enfermedad a tratar. En estos casos, el enfoque terapéutico se centra exclusivamente en controlar el dolor, utilizando todas las herramientas disponibles desde farmacología hasta neurocirugía funcional.
Situación actual del tratamiento
El tratamiento del dolor ha evolucionado considerablemente, desde abordajes puramente ablativos hasta técnicas sofisticadas de neuromodulación. La comprensión de los mecanismos fisiopatológicos ha permitido desarrollar estrategias terapéuticas más selectivas y efectivas.
Teoría de la compuerta de Melzack y Wall
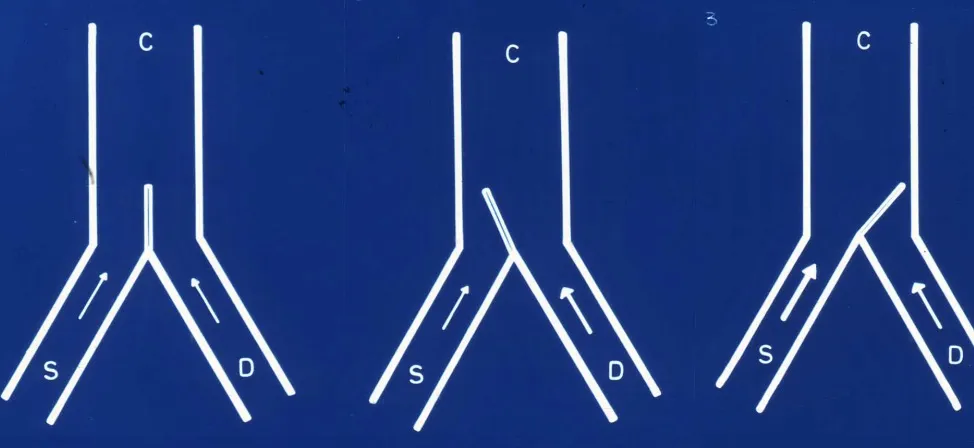
En 1965, Ronald Melzack y Patrick Wall propusieron la teoría de la compuerta (gate control theory), revolucionando la comprensión de los mecanismos de modulación del dolor. Esta teoría, aunque simplificada respecto a lo que ahora sabemos, sigue siendo conceptualmente válida y fundamenta muchos tratamientos actuales.
La teoría propone que existe un mecanismo de compuerta en el asta posterior medular que regula el paso de información dolorosa hacia centros superiores. Esta compuerta puede abrirse o cerrarse dependiendo del balance entre diferentes tipos de información sensorial que llegan simultáneamente.

En condiciones normales, cuando no hay dolor, la compuerta permite que la información sensitiva sensorial (visual, olfativa, táctil) llegue adecuadamente al cerebro. El sistema del dolor está presente pero inactivo, permitiendo el procesamiento normal de las sensaciones.
Cuando se activa un estímulo doloroso intenso, la compuerta comienza a cerrarse progresivamente, impidiendo que llegue de forma normal la información sensitiva no dolorosa. Este mecanismo tiene sentido evolutivo: el dolor indica peligro potencial para el organismo, por lo que el cerebro prioriza esta información sobre otras sensaciones para permitir una respuesta defensiva rápida.
El aspecto revolucionario de esta teoría fue demostrar que el sistema funciona en ambas direcciones. Si aumentan los estímulos sensitivos no dolorosos (fibras Aβ), la compuerta puede inhibir la entrada del dolor. Este principio explica por qué frotarse una zona dolorida proporciona alivio temporal: las fibras del tacto compiten con las fibras del dolor, modulando la transmisión nociceptiva.
Un ejemplo cotidiano ilustra este mecanismo: el dolor de muelas resulta especialmente intenso por la noche, cuando hay menos estímulos sensitivos competidores. Durante el día, la mayor entrada de información sensorial puede atenuar parcialmente la percepción del dolor dental.
Esta teoría fundamenta dos estrategias terapéuticas neuroquirúrgicas complementarias. Por un lado, si el dolor resulta abrumador, podría cortarse la vía del dolor en algún punto del sistema nervioso, haciendo que la compuerta vuelva a su posición neutral. Por otro lado, puede aumentarse la información sensitiva mediante neuroestimulación, incrementando las aferencias sensitivas que cierran la compuerta y compiten con el dolor.
Tratamiento quirúrgico mediante lesión
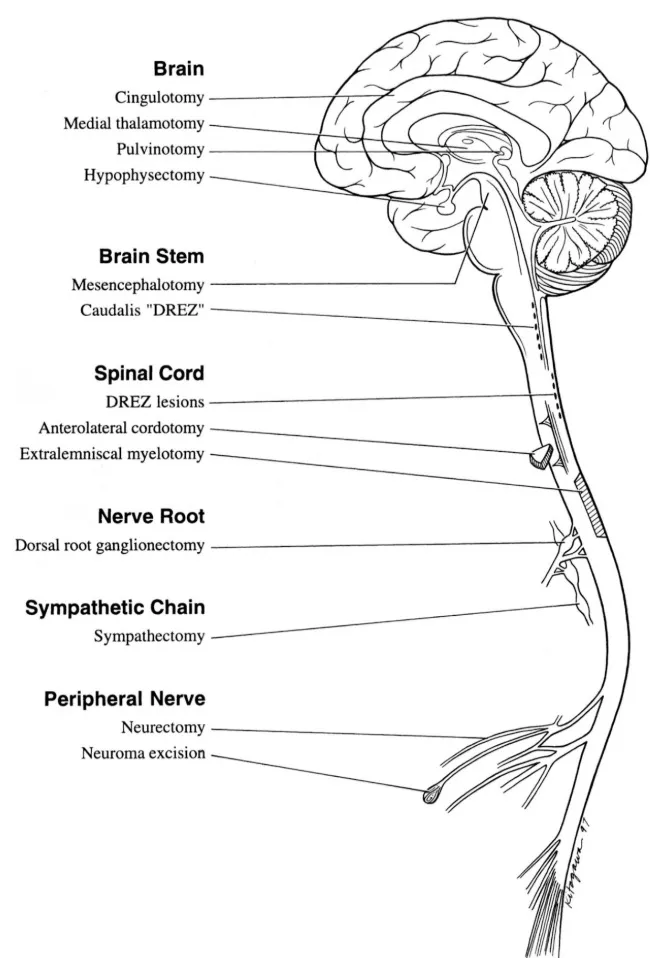
Los procedimientos ablativos fueron las primeras técnicas neuroquirúrgicas desarrolladas para el control del dolor. Aunque actualmente se reservan para situaciones específicas, mantienen un papel en casos seleccionados, particularmente en dolor oncológico con expectativa de vida limitada.
Las técnicas ablativas pueden dirigirse tanto al dolor nociceptivo como al neuropático, aunque con resultados variables. La neurectomía periférica secciona nervios específicos, siendo efectiva para dolores muy localizados pero con riesgo de generar dolor neuropático iatrogénico. La rizotomía secciona las raíces dorsales, útil en dolores localizados a dermatomas específicos.
A nivel medular, la cordotomía anterolateral interrumpe el tracto espino-talámico, proporcionando analgesia contralateral para dolor oncológico en hemicuerpo. La mielotomía comisural secciona las fibras que cruzan en la línea media, útil para dolor visceral. La tractotomía mesencefálica lesiona el tracto espino-talámico en el mesencéfalo.
Las lesiones en zona de entrada de raíz dorsal (DREZ) resultan particularmente efectivas para dolor por avulsión de plexo braquial y dolor tras lesión medular. La talamotomía medial se dirige al componente afectivo del dolor. La cingulotomía modifica la respuesta emocional al dolor sin alterar la percepción sensorial.
El principal problema de las técnicas ablativas es que, al generar desaferentización, pueden paradójicamente crear dolor neuropático central. Además, la analgesia puede deteriorarse con el tiempo por reorganización plástica del sistema nervioso. Por estas razones, actualmente se prefieren técnicas de neuromodulación cuando es posible.
Tratamiento quirúrgico mediante neuroestimulación
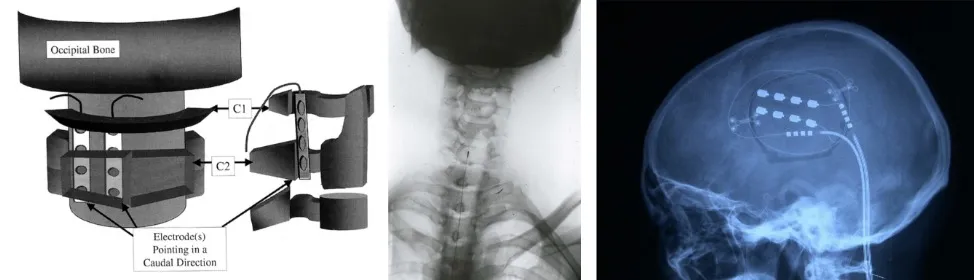
La neuroestimulación representa el paradigma actual del tratamiento neuroquirúrgico del dolor, basándose en el principio de la teoría de la compuerta. En lugar de destruir estructuras nerviosas, estas técnicas modulan la actividad neuronal mediante estimulación eléctrica, siendo reversibles y ajustables.
La estimulación de nervios periféricos y raíces nerviosas constituye la opción menos invasiva, colocando electrodos sobre nervios específicos o raíces dorsales para generar parestesias que enmascaran el dolor en el territorio correspondiente.
La estimulación medular (spinal cord stimulation, SCS) representa la técnica de neuromodulación más utilizada. Se implantan electrodos en el espacio epidural sobre los cordones posteriores, estimulando las fibras Aβ del tacto. Esta estimulación cierra la compuerta del dolor en el asta posterior medular. Resulta particularmente efectiva en síndrome postlaminectomía, dolor neuropático de extremidades y neuropatías periféricas. Los sistemas modernos incluyen múltiples programas de estimulación y la capacidad de estimulación de alta frecuencia.
La estimulación cerebral profunda se utiliza para dolores refractarios, con diferentes dianas según el tipo de dolor. La estimulación de VPM-VPL (núcleos ventral posteromedial y posterolateral del tálamo) resulta efectiva para dolor neuropático con componente discriminativo preservado. La estimulación de PAG-PVG (sustancia gris periacueductal y periventricular) activa sistemas descendentes de control del dolor, siendo útil para dolor nociceptivo refractario.
Más recientemente, la estimulación del córtex motor se ha desarrollado como alternativa para dolor neuropático central, particularmente efectiva en dolor post-ictus y dolor facial neuropático. La estimulación cortical parece modular circuitos talámicos mediante proyecciones córtico-talámicas.
La estimulación del hipotálamo se ha explorado experimentalmente para cefaleas en racimos refractarias, aunque su uso permanece limitado a centros muy especializados.
Las ventajas de la neuroestimulación incluyen su reversibilidad, ajustabilidad de parámetros y menor riesgo de generar dolor neuropático iatrogénico. Sin embargo, requieren implantación de dispositivos, tienen costes iniciales elevados y necesitan recambios de batería periódicos. La selección adecuada de pacientes mediante pruebas de estimulación temporal resulta crucial para identificar quiénes se beneficiarán de estos tratamientos.
Unidad del dolor
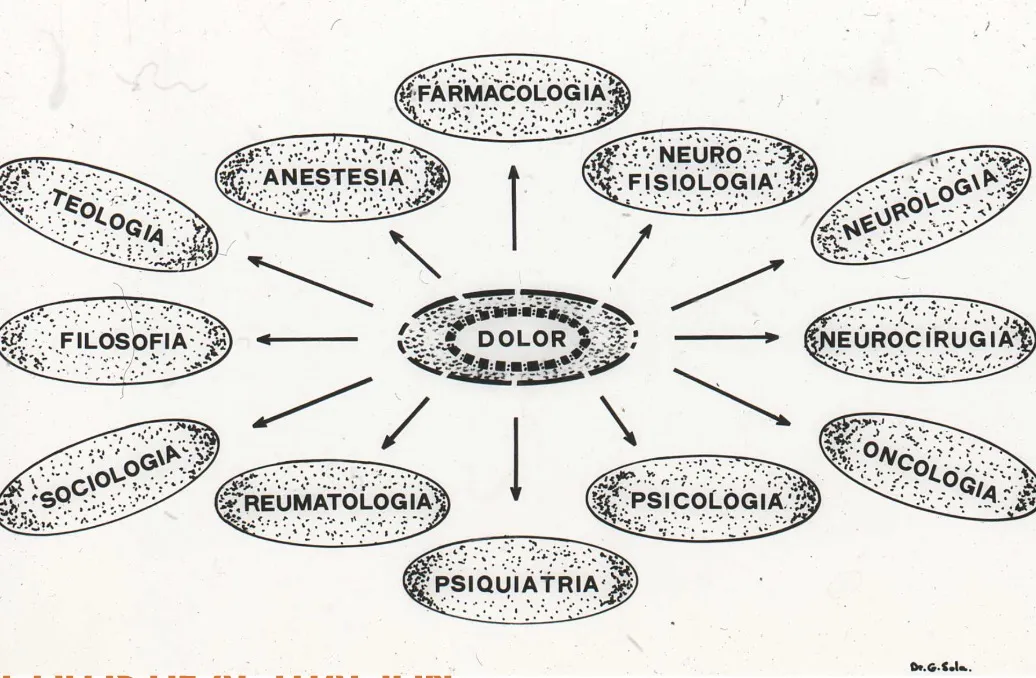
El tratamiento óptimo del dolor requiere un abordaje multidisciplinar que integre diferentes especialidades y perspectivas terapéuticas. Las unidades del dolor constituyen estructuras asistenciales especializadas donde convergen profesionales de diversas disciplinas para ofrecer una atención integral y coordinada.
Organización multidisciplinaria
Una unidad del dolor moderna debe integrar especialistas en anestesiología, neurocirugía, neurología, neurofisiología, psiquiatría, psicología, farmacología, fisioterapia, rehabilitación, oncología, reumatología y enfermería especializada. Esta composición multidisciplinar permite abordar los múltiples aspectos del dolor crónico: físico, emocional, social y funcional.
La filosofía subyacente reconoce que el dolor, especialmente cuando se cronifica, afecta a la persona en su totalidad. Los aspectos físicos del dolor no pueden separarse de sus consecuencias psicológicas, sociales y laborales. Un abordaje fragmentado resulta invariablemente insuficiente.
Protocolos de actuación
Las unidades del dolor trabajan mediante protocolos de actuación basados en la evidencia científica. Estos protocolos guían la evaluación inicial, establecen algoritmos diagnósticos y proponen secuencias terapéuticas según el tipo de dolor. La estandarización mediante protocolos no implica rigidez, sino garantizar que todos los pacientes reciben una evaluación completa y se consideran todas las opciones terapéuticas disponibles.
Los protocolos incluyen criterios de derivación entre especialidades, indicaciones para técnicas intervencionistas, criterios de selección para tratamientos neuroquirúrgicos y pautas de seguimiento a largo plazo. La revisión periódica de estos protocolos permite incorporar nuevos conocimientos y técnicas emergentes.
Diseño del tratamiento individualizado
A pesar de la existencia de protocolos, cada paciente requiere un plan terapéutico individualizado. Este diseño considera múltiples factores: tipo de dolor (nociceptivo versus neuropático), temporalidad (agudo versus crónico), pronóstico (benigno versus maligno), estadio evolutivo según Hendler, comorbilidades médicas y psiquiátricas, situación social y laboral, tratamientos previos y respuesta a los mismos, expectativas del paciente y objetivos terapéuticos realistas.
El tratamiento se estructura habitualmente de forma escalonada, comenzando con las opciones menos invasivas (farmacológicas, fisioterapia, apoyo psicológico) y avanzando hacia técnicas intervencionistas (bloqueos nerviosos, radiofrecuencia) y finalmente neuroquirúrgicas (neuroestimulación, técnicas ablativas) cuando las anteriores resultan insuficientes.
La evaluación continua de resultados permite ajustar el plan terapéutico. Los objetivos no siempre incluyen la eliminación completa del dolor, sino frecuentemente la reducción a niveles tolerables que permitan mejorar la funcionalidad y calidad de vida. En algunos casos, especialmente en dolor crónico muy evolucionado, el objetivo principal puede ser facilitar la adaptación del paciente a vivir con dolor, minimizando su impacto en la vida cotidiana.
Conclusión
El dolor representa un fenómeno complejo que trasciende la simple transmisión de señales nociceptivas, integrando componentes sensitivos, emocionales, cognitivos y conductuales. La comprensión de los mecanismos fisiopatológicos del dolor ha progresado notablemente, revelando una organización anatómica y funcional extraordinariamente sofisticada que incluye vías ascendentes múltiples, sistemas descendentes de modulación y plasticidad neuronal que puede perpetuar el dolor más allá de la lesión inicial.
La distinción entre dolor nociceptivo y neuropático resulta fundamental, no solo por sus diferentes mecanismos fisiopatológicos sino por sus implicaciones terapéuticas radicalmente diferentes. Mientras el dolor nociceptivo responde generalmente bien a analgésicos convencionales y a la resolución de la causa subyacente, el dolor neuropático requiere frecuentemente abordajes farmacológicos específicos y puede beneficiarse de técnicas de neuromodulación.
La evolución temporal del dolor descrita por Hendler en cuatro estadios proporciona un marco conceptual valioso para comprender no solo la progresión de los síntomas físicos sino también las profundas alteraciones psicológicas y sociales que acompañan al dolor crónico. Esta perspectiva evolutiva enfatiza la importancia de la intervención temprana para prevenir la cronificación y sus devastadoras consecuencias.
El desarrollo de técnicas neuroquirúrgicas para el tratamiento del dolor refleja la evolución de nuestra comprensión fisiopatológica. Desde los procedimientos ablativos iniciales hasta las sofisticadas técnicas de neuroestimulación actuales, el arsenal terapéutico ha crecido sustancialmente. La teoría de la compuerta de Melzack y Wall continúa proporcionando un marco conceptual para entender cómo estas intervenciones modulan el procesamiento del dolor.
Finalmente, el abordaje del dolor crónico requiere inevitablemente un enfoque multidisciplinar integrado en unidades especializadas. Solo mediante la colaboración entre diferentes especialidades puede ofrecerse una atención verdaderamente integral que contemple todos los aspectos de esta experiencia compleja. En la segunda parte de esta serie, exploraremos en detalle las técnicas neuroquirúrgicas específicas disponibles para el tratamiento del dolor refractario.