ESTIMULACION OCCIPITAL: Introducción
– Cefaleas primarias-46% Población
– Crónicas diarias 3%
– Tratamientos preventivos efectivos 50%
Historia
Scribonis Largus “Compositiones” 46 Ac
William Gilger (1544-1603), imantación, electricidad
Otto Guericke– primera máquina-electricidad
Kratzenstein y Krugger, en 1744, y Jakob Hermanna Klyn, en 1746
Richard Lovett, en 1756, “Subtil Medium Proved”, el primero sobre aplicaciones médicas de la electricidad
John Wesley, electroterapia, “The Desideratum”, 1769:
– cefaleas, ciáticas, dolor pleurítico, angina de pecho y dolor de tipo isquémico
Galvani y, pila eléctrica por Volta (1800)
Duchenne de Bolulogne (1825)
Hermel, Sarlandiere, 1844, electropuntura
Cerletti y Bini, 1938- TEC
Hess: años 30- manifestaciones motoras y emocionales
Melzach y Wall, 1967
Mazars 1961- estimulación talámica VPL
Shealy, 1967, cordones posteriores
Reynolds 1969, SGPA rata
Wall y Sweet en 1967, ondas de 0,1 milisegundos a 100 Hz en 8 pacientes con dolor de origen cutáneo, de raíz o tronco nervioso; Para el 50% pacientes, el alivio del dolor se prolongaba media hora tras cesar la estimulación, cuando se aplicaba por dos minutos
(Wall PD, Sweet WH. Temporary abolition of pain in man. Science. Jan 6 967;155(758):108-109)
Tens:
– Alta frecuencia: 50-100 Hz, 60 microseg, 50-60 mA
– Baja frecuencia: 1-4 Hz, 200-300 microseg, contractura muscular
– Estimulacion intensa y breve, 150 Hz, 150 microseg
A) Rectangular asimétrica bifásica
B) Rectangular simétrica bifásica
C) En espiga
Dolor agudo: sustituir y coadyuvar en la medicación, útil en un 80%
Dolor crónico : beneficio a largo plazo no mayor del 50% y solo en un 33% de los casos en que se utiliza como única terapia
Predecir éxito estimuladores implantables
NEUROESTIMULACIÓN
– Estimulación nervios periféricos
– Estimulación medular analgésica
– Estimulación motora cortical
– Estimulación cerebral profunda
ESTIMULACION OCCIPITAL
Introducida por Weiner y Reed en 1999:
– 13 pacientes con 17 implantes
– seguimientos de 18 meses a 6 años
Respondedores 12 pacientes con mínima o sin medicación
MIGRAÑA
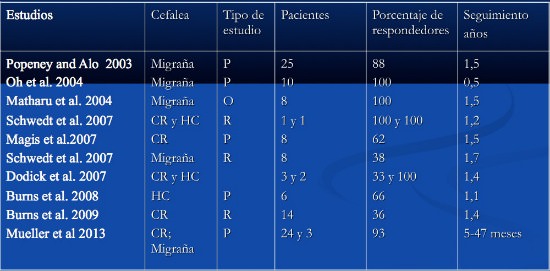
Popeney C, Alo K. Peripheral neurostimulation for the treatment of chronic, disabling transformed migraine. Headache. 2003;43:369-375.
– 25 pacientes, 18 meses, 88% respuesta. 9 migraciones electrodo 1 infección
– Respondedores (84%)
Oh MY, Ortega J, Bradley Bellotte J, et al. Peripheral nerve stimulation for the treatment of occipital neuralgia and transformed migraine using a C1-2-3 subcutaneous paddle style electrode: a technical report. Neuromodulation 2004; 7:103–112.
Matharu M, Bartsch T, Ward N, et al. Central neuromodulation in chronic migraine patients with suboccipital stimulators: a PET study. Brain 2004; 127:220–230.
Schwedt TJ, Dodick DW, Hentz J, et al. Occipital nerve stimulation for chronic headache: long-term safety and efficacy. Cephalalgia 2007; 27:153–157.
Lipton 2009: 132 12 grupo activo reducción días 5.5 vs. 3,9 control
VAS 27% vs. 20 % no estadísticamente significativo
Silberstein 2012: 157 2:1 activa o control
12 semanas reducción mayor del 30 %. Reducción días de dolor de −3.1 mes y en discapacidad del 44.1
Machioretto 2012: 34 pacientes, P, random. Midas A 70 a 14
Slotty 2014: 8 pacientes. Todos mejoraron. Mejor con parestesia
Lipton RB, Goadsby PJ, Cady RK, et al. PRISM study: occipital nerve stimulation for treatment-refractory migraine [abstract PO47]. Cephalalgia. 2009;29(1 Suppl 1):30.
Silberstein SD, Dodick DW, Saper J, et al. Safety and efficacy of peripheral nerve stimulation of the occipital nerves for the management of chronic migraine: results from a randomised, multicenter, double blinded, control study. Cephalalgia. 2012;32(16): 1165–79.
Slotty P1, Bara G, Kowatz L, Gendolla A, Wille C, Schu S, Vesper J. Occipital nerve stimulation for chronic migraine: A randomized trial on subthreshold stimulation. Cephalalgia. 2014 May 8
ONSTIM
ONSTIM: Estudio multicéntrico, prospectivo, randomizado, simple ciego, controlado
– 75 /110 tratados, datos disponibles en 66.
-Respondedor 50% de reducción en la frecuencia o 3 puntos menos en la escala de dolor a los 3 meses:
- 39% para estimulación occipital ajustable,
- 6% para los de la estimulación fija
- 0% para tratamiento médico.
-12/51 migración electrodo (24%)
Saper JR, Dodick DW, Silberstein SD, McCarville S, Sun M, Goadsby PJ. Occipital nerve stimulation for the treatment of intractable chronic migraine headache: ONSTIM feasibility study. Cephalalgia. 2011
NEURALGIAS TRIGEMINALES AUTONOMICAS
Cefaleas primarias acompañadas de manifestaciones autonómicas:
– ptosis palpebral, lagrimeo, congestión nasal y rinorrea, síndrome de Horner (ptosis palpebral, miosis y enoftalmos) y cambios de coloración de la piel periocular y de la mejilla.
– cefalea en racimos
– hemicránea paroxística
– síndrome de cefalea unilateral neuralgiforme, de corta duración, con inyección conjuntival y lagrimeo
– hemicránea continua
ESTUDIOS CEFALEAS TRIGEMINALES
Schwedt 2006:
– 3/4 pacientes con CR respuesta
Magis et al 2007: estudio prospectivo
– 8 pacientes CR, seguimiento 15 meses
– 2 pacientes sin dolor, 80% reducción del 90%, 1 paciente reducción del 40%
Wilbrink et al
De Quintana-Schmidt C, Casajuana-Garreta E,Molet-Teixido J, et al. Stimulation of the occipital nerve in the treatment of drug-resistant cluster headache. Rev Neurol. 2010;1:19-26.
Magis D, Allena M, Bolla M, et al. Occipital nerve stimulation for drug-resistant chronic cluster headache: a prospective pilot study. Lancet Neurol 2007; 6:314–321.
Burns B, Watkins L, Goadsby PJ. Treatment of intractable chronic cluster headache by occipital nerve stimulation in 14 patients. Neurology 2009; 72:341–345.
Wilbrink LA, Teernstra OP, Haan J, et al. Occipital nerve stimulation in medically intractable, chronic cluster headache. The ICON study: rationale and protocol of a randomised trial. Cephalalgia. 2013;33(15):1238–47.
CEFALEA EN RACIMOS
Burns B 2009: estudio retrospectivo
– 14 pacientes, seguimiento 17,5 meses (rango 4-35)
– 10 mejoraron significativamente: 3 más del 90%, 3 moderado mayor del 40% y 4 del 20-30%
– 3 infecciones y una migración de electrodo
De Quintana et al 2010
– 4 pacientes, 50% mejoría 6 meses
CEFALEAS TRIGEMINALES
Magis et al 2011:
– 14 pacientes CR, seguimiento 36.82 meses (rango 11-64 meses)
– 3 pacientes sin dolor, 11 reducción del 90%, de mejoría con un 60% estando libres de dolor durante largos periodos, 4 (29%) pudieron reducir su profilaxis.
– Una infección
– Ataques contralterales (N=5/14, 36%), y ataques autonómicos sin dolor (N=5/14, 36%).
Magis D1, Gerardy PY, Remacle JM, Schoenen J. Sustained effectiveness of occipital nerve stimulation in drug-resistant chronic cluster headache. Headache. 2011 Sep;51(8):1191-201.
NEURALGIAS TRIGEMINALES
Hemicrania continua
Schwedt 2006, 2007, 2 pacientes, respuesta
– La que mejor responde a estimulación 7/9 (77%) pacientes con al menos 50% de mejoría con un seguimiento de un año
Burns et al 2008
– 6 pacientes, seguimiento medio de 13.5 meses (rango 6-21 meses)
– 4 (80-95%) de mejoría, 1 paciente 30% de mejoría, y 1 paciente empeoramiento
Burns B1, Watkins L, Goadsby PJ. Treatment of hemicrania continua by occipital nerve stimulation with a bion device: long-term follow-up of a crossover study. Lancet Neurol. 2008
OTRAS CEFALEAS
Goadsby et al 2007
– Hemicrania paroxística: 2/3 respuesta
– SUNCT- ½ respuesta
Lambru 2014
– 9 pacientes, 32 meses, 8 respondieron
Goadsby PJ. Neurostimulation in primary headache syndromes. Expert Rev Neurother. 2007 Dec;7(12):1785-9
Lambru G, Shanahan P, Watkins L, Matharu MS1. Occipital nerve stimulation in the treatment of medically intractable SUNCT and SUNA Pain Physician. 2014 Jan-Feb;17(1):29-41.
OTRA ESTIMULACIÓN
Estimulación auriculotemporal
Simopoulos 2010: Migraña 1 paciente 16 meses bilateral
Estimulación supraorbitaria
1 paciente unilateral 14 meses
Combinada:
Reed et al 2010: 47 CR 7 pacientes 100% respuesta, 14% migraciones
Simopoulos T, Bajwa Z, Lantz G, Lee S, Burstein R. Implanted auriculotemporal nerve stimulation for the treatment of refractory chronic migraine. Headache.2010;50:1064-1069.
Narouze SN, Kapural L. Supraorbital nerve electric stimulation for the treatment of intractable chronic cluster headache:A case report. Headache. 2007;47:1100-1102.
ESTIMULACIÓN ESFENOPALATINA
Ibarra 2007 1 paciente CR, 9 meses
Ansarinia 2010 6 pacientes CR 14/18 respondieron
Tepper 2010 10 pacientes 20% respuesta
Schoenen 2013: 28 pacientes 67,1% respuesta
T Ibarra E. Neuromodulation del ganglio esfenopalatino para aliviar los síntomas de la cefalea en racimos. Reporte un Caso Boletin Dolor. 2007;46:12
Ansarinia M, Rezai A, Tepper SJ, et al. Electricalstimulation of sphenopalatine ganglion (SPG) for acute treatment of cluster headaches. Headache. 2010;50:1164-1174.
Tepper SJ, Rezai A, Narouze S, Steiner C, Mohajer P, Ansarinia M. Acute treatment of intractable migraine with sphenopalatine ganglion electrical stimulation. Headache. 2009;49:983-989. epper 2009 10 pacientes migraña 50%
Schoenen J, Jensen RH, Lanteri-MinetM, et al. Stimulation of the sphenopalatine ganglion (SPG) for cluster headache treatment. Pathway CH-1: a randomized, sham-controlled study. Cephalalgia. 2013;33(10):816–30
ESTUDIOS DE CEFALEA
INDICACIONES
– Neuralgia occipital
– Migraña
– Neuralgias trigeminales
– Posttraumáticas
– Cervicogénicas
– Neuralgias
– Chiari
MECANISMO DE ACCION
Excitabilidad del nervio periférico:
-enlentecimiento de la velocidad de conducción,
-incremento en el umbral eléctrico
-disminución en la probabilidad de respuesta
Neuromodulación
-red segmental neuronal ‘teoría de la compuerta’ de Melzack and Wall
Goadsby PJ1, Bartsch T, Dodick DW. Occipital nerve stimulation for headache: mechanisms and efficacy..Headache. 2008 Feb;48(2):313-8.
Goadsby PJ, Bartsch T, Dodick DW. Occipital nerve stimulation for headache: mechanisms and efficacy. Headache 2008; 48:313–318.
Ignelzi RJ, Nyquist JK. Excitability changes in peripheral nerve fibers after repetitive electrical stimulation. Implications in pain modulation. J Neurosurg 1979; 51:824–833.
Chung JM, Lee KH, Hori Y, et al. Factors influencing peripheral nerve stimulation produced inhibition of primate spinothalamic tract cells. Pain 1984; 19:277–293.
Doubell T, Mannion, RJ, Woolf, CJ. The dosral horn: state dependent sensory processing, plasticity and the generation of pain. 4th ed. Melzack PDWR, editors. Textbook of pain. Livingstone: Churchill; 1999; 59:165–180.
Estímulos dolorosos en V y C2-C3 van al mismo complejo trigeminal nociceptivo desde el núcleo caudalis a C2 (Dr. Peter Goadsby)
CONTROVERSIAS
Anestesia general o local
Electrodo cilíndrico o tipo remo
Miniatura
Periodo de prueba
EFECTOS ADVERSOS
La técnica es segura no existe ningún déficit neurológico iatrogénico persistente publicado.
Riesgo bajo de infección- hasta el 20%
Alta frecuencia de migración del electrodo, traumática o espontánea
Reemplazamiento de generador de pulso y malfunción o fractura.
Dolor en el emplazamiento del generador o sensación de parestesia considerada insoportable
Contractura muscular
La mayoría de los pacientes están satisfechos y recomendarían el procedimiento a otros
Referencias
Linderoth B, Foreman RD. Mechanisms of spinal cord stimulation in painful syndromes: role of animal Models. Pain Med 2006; 7:S14–S26.
Linderoth B, Foreman RD. Physiology of spinal cord stimulation: review and update. Neuromodulation 1999; 2:150–164.
Garrison DW, Foreman RD. Effects of transcutaneous electrical nerve stimulation (TENS) on spontaneous and noxiously evoked dorsal horn cell activity in cats with transected spinal cords. Neurosci Lett 1996; 216:125– 128.
Kolmodin GM, Skoglund CR. Analysis of spinal interneurons activated by tactile and nociceptive stimulation. Acta Physiol Scand 1960; 50:337–355.
Woolf CJ. Transcutaneous electrical nerve stimulation and the reaction to experimental pain in human subjects. Pain 1979; 7:115–127.
Lindblom U, Tapper DN, Wiesenfeld Z. The effect of dorsal column stimulation on the nociceptive response of dorsal horn cells and its relevance for pain suppression. Pain 1977; 4:133–144.
Garrison D, Foreman R. Decreased activity of spontaneous and noxiously evoked dorsal horn cells during transcutaneous electrical nerve stimulation (TENS). Pain 1994; 58:309–315.
Knight YE, Bartsch T, Goadsby PJ. Trigeminal antinociception induced by bicuculline in the periaqueductal gray (PAG) is not affected by PAG P/Q-type calcium channel blockade in rat. Neurosci Lett 2003; 336:113–116.
Stiller CO, Linderoth B, O’Connor WT, et al. Repeated spinal cord stimulation decreases the extracellular level of gamma-aminobutyric acid in the periaqueductal gray matter of freely moving rats. Brain Res 1995; 699:231–241.
Duggan AW, Foong FW. Bicuculline and spinal inhibition produced by dorsal column stimulation in the cat. Pain 1985; 22:249–259.
Stiller CO, Cui JG, O’Connor WT, et al. Release of gamma-aminobutyric acid in the dorsal horn and suppression of tactile allodynia by spinal cord stimulation in mononeuropathic rats. Neurosurgery 1996; 39:367–374; discussion 374–365.
Hautvast RW, Ter Horst GJ, DeJong BM, et al. Relative changes in regional cerebral blood flow during spinal cord stimulation in patients with refractory angina pectoris. Eur J Neurosci 1997; 9:1178–1183.
Olausson B, Xu ZQ, Shyu BC. Dorsal column inhibition of nociceptive thalamic cells mediated by gamma-aminobutyric acid mechanisms in the cat. Acta Physiol Scand 1994; 152:239–247.
Gildenberg PL, Murthy KS. Influence of dorsal column stimulation upon human thalamic somatosensory-evoked potentials. Appl Neurophysiol 1980; 43:8–17.
Weiller C, May A, Limmroth V, et al. Brain stem activation in spontaneous human migraine attacks. Nat Med 1995; 1:658–660.
Bahra A, Matharu MS, Buchel C, et al. Brainstem activation specific to migraine headache. Lancet 2001; 357:1016–1017.
Serra G1, Marchioretto F. Occipital nerve stimulation for chronic migraine: a randomized trial.Pain Physician. 2012 May-Jun;15(3):245-53.
